Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Самосборка макромолекулярных структур
Если рост жгутиков бактерий (дополнение 4-Б) можно легко представить как результат прохождения субъединиц через центральную полость, то понять, как образуются более сложные структуры, например мышечные саркомеры, довольно трудно. Недавно в этой области был достигнут значительный прогресс, главным образом благодаря наблюдениям за процессом самосборки бактериофагов. На рис. 4-8 в качестве примера изображен процесс сборки нитчатого фага из молекул гидрофобного белка и ДНК. Белковые субъединицы синтезируются и сохраняются в бактериальной мембране. Небольшие а-спирали легко умещаются в мембране и могут оставаться там до тех пор, пока в мембрану не попадет молекула ДНК. Мы не знаем, как инициируется процесс самосборки, однако, судя по всему, каждая субъединица имеет участок связывания с ДНК. Участки поверхности субъединиц обладают гидрофобными свойствами и, взаимодействуя между собой, субъединицы самопроизвольно «покрывают» поверхность ДНК. После окончания сборки «палочки» гидрофобные группы оказываются «утопленными» внутри структуры. Предполагается, что группы, расположенные на наружной поверхности вирусной частицы, обладают гидрофильными свойствами и что образование такой гидрофильной «палочки» и является движущей силой, обеспечивающей автоматическое выталкивание фага из мембраны [39]. Аналогичным путем могут выталкиваться и пили бактерий. Они образуются очень быстро и могут, вероятно, втягиваться обратно в бактериальную мембрану.
Наиболее ярким примером самосборки служит процесс сборки Т-четных фагов (дополнение 4-Д) [101—103]. Результаты тщательного генетического анализа (гл. 15, разд. Г.2) показали, что для образования головки требуется по крайней мере 18 генов, для образования отростка — 21 ген, а для образования нитей — 7 генов. Большинство этих генов кодирует белки, которые непосредственно включаются в зрелую вирусную частицу, однако несколько генов детерминируют специфические ферменты, необходимые для процесса сборки. Получены мутантные штаммы вируса, способные синтезировать все структурные белки, кроме одного. В этом случае все синтезированные белки скапливались внутри хозяйской бактериальной клетки и не агрегировали. Однако при добавлении недостающего белка (синтезированного бактерией, инфицированной вирусом другого штамма) быстро осуществлялась сборка полноценных вирусных частиц. Эти и другие данные позволили сделать вывод, что белки присоединяются к растущей структуре в строго определенной последовательности. Присоединение одного белка формирует связывающий участок для следующего.
Дополнение 4-Д
Т-четные бактериофаги
Одним из наиболее интересных объектов, которые удается наблюдать под электронным микроскопом, являются Т-четные бактериофаги (Т2, Т4 и Т6), инфицирующие бактерии Е. соliа-в. Путь проникновения многих вирусов в клетку неизвестен, и Т-четные фаги являются редким исключением. Эти частицы действуют как своего рода «молекулярные шприцы», прокалывая клеточную стенку бактерий-хозяев и впрыскивая в них свою ДНК. Вирусная частица, длина которой 200 нм, а масса ~255∙106 дальтон, содержит в своей головке, имеющей форму вытянутого икосаэдра размером 100X70 нм, приблизительно 130∙606 дальтон ДНК. Поверхность головки бактериофага построена из ~840 одинаковых белковых молекул с мол. весом 45 000 (кодируемых геном 23), организованных в виде 140 гексамеров, и из ~55 молекул другого белка, образующих 11 пентамеровг. Головка содержит по крайней мере девять других белков, включая три внутренних основных белка, которые проникают внутрь бактерии вместе с ДНК.
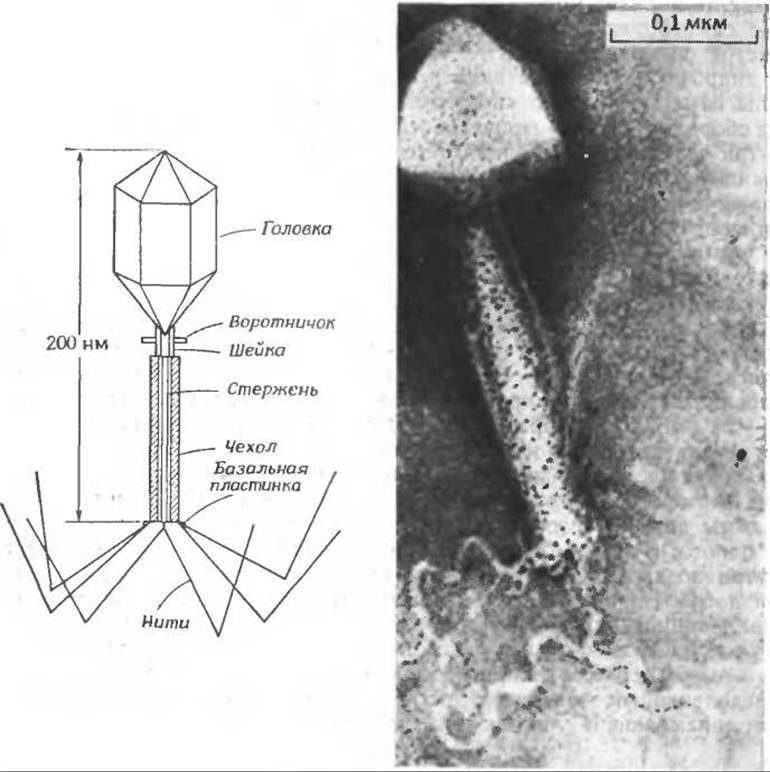
Фаг с отростком, инфицирующий Bacillus subtilis. (С любезного разрешения А. С. Тихоненко.)
Отросток фага имеет внутренний стержень с отверстием 2,5 нм, диаметр которого достаточен для того, чтобы молекула ДНК могла проникнуть через него внутрь бактерии. Окружающий стержень чехол (его масса 8∙106 дальтон) построен из 144 белковых субъединиц с мол. весом ~ 55 000, собранных в виде 24 колец, каждое из которых состоит из шести субъединиц. Чехол способен сокращаться, уменьшая свою длину от 80 до 30 нм; он продавливает стержень сквозь стенку бактерии. На конце отростка имеется базальная пластинка шестиугольной формы, несущая ряд коротких шипов, а также шесть длинных нитей, каждая из которых состоит из шести субъединиц с мол. весом ~ 100000. Среди 10 белков, образующих базальную пластинку, был обнаружен специфический белок лизоцимд. Помимо всего прочего, вирусная частица содержит ряд небольших молекул. Например, около 30% отрицательно заряженных групп ДНК нейтрализованы полиаминами — путресцином и спермидином (гл. 14, разд. В.4). В базальной пластинке отростка содержится шесть молекул кофермента — 7,8-дигидроптероилгексаглутамата (гл. 8. разд. Л).
Как происходит заражение бактерии Т-четным фагом? Процесс начинается с присоединения нитей отростка к специфическим рецепторным участкам на поверхности бактерии. Это вызывает ряд конформационных изменений в нитях, базальной пластинке и чехле. При этом из базальной пластинки высвобождается лизоцим и разрушает стенку бактерии. Сокращение чехла начинается с базальной пластинки и далее распространяется к основанию. После того как стержень, проникнет в бактерию, ДНК быстро впрыскивается в клетку хозяина.
В процессе сокращения субъединицы чехла перестраиваются, образуя структуру из 12 колец большего размера, каждое из которых состоит из 12 субъединице. Происходит своеобразное взаимное проникновение субъединиц (интеркаляция). Строго определенная направленность и необратимый характер этой структурной перестройки отличают укорочение отростка фага от процесса сокращения мышцы. Вполне возможно, что в чехле фага белковые субъединицы находятся в нестабильном высокоэнергетическом состоянии и запасенная в процессе сборки энергия используется затем для реализации процесса сокращения.
а Wood W. В., Edgar R. S., Sсi. Am., 217, 60—72 (Jul. 1967).
б Mathews С. К., Bacteriophage Biochemistry, Van Nostrand-Reinhold, Princeton, New Jersey, 1971.
в Cummings D. J., Couse N. C., Forrest C. L., Adv. Virus Res., 16, 1—41 (1970).
г Branton D., Klug A., JMB, 92, 559—565 (1975).
д Not to be confused in its catalytic properties with the better known lysozyme of egg white (Fig. 2—9 and Chapter 7, Section C, 4, a).
е Moody M. F., JMB, 80, 613—635 (1973).
Детально изучен процесс сборки отростка фага. Шесть копий каждого из трех белков собираются в одной последовательности, образу» «втулку», обладающую гексагональной симметрией (рис. 4-26). Параллельно семь других белков соединяются друг с другом, образуя структуру, напоминающую по форме клин. Затем шесть таких клиньев собираются вокруг «втулки», образуя шестиугольную базальную пластинку. Только после этого к поверхности базальной пластинки присоединяются еще два белка, которые активируют ее, в результате чего начинается сборка стержня отростка. По завершении этого процесса начинается сборка чехла отростка из структурных единиц и только после того, как трубчатая структура достигает требуемой длины, к ее вершине присоединяется белок головки. Затем над отростком формируется «головка» и далее начинают присоединяться нити отростка, сборка которых осуществляется отдельно.
Представить себе, каким образом каждая стадия этого сложного» процесса сборки создает предпосылки для реализации последующей стадии, очень трудно. Тем не менее имеющиеся данные весьма убедительны. Вероятно, структура очередного присоединившегося белка остается устойчивой только до тех пор, пока не произойдет специфического присоединения к нему другого белка. Энергия взаимодействия оказывается достаточной для того, чтобы вызвать конформационное изменение в другой части белковой молекулы, приводящее к появлению участка, комплементарного участку связывания следующего белка. Замечательно, что способностью к самоактивации должен обладать каждый из белков базальной пластинки.
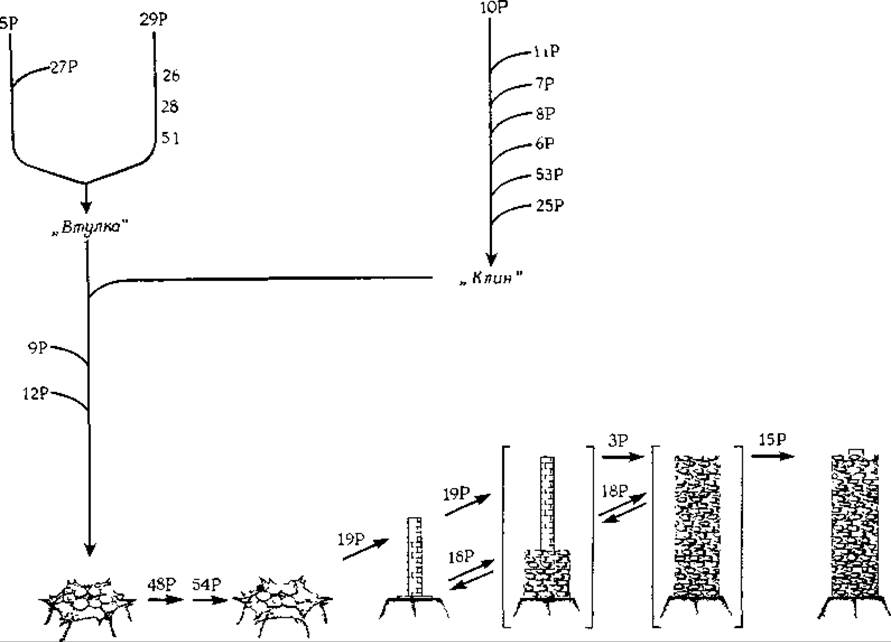
РИС. 4-26. Последовательные стадии процесса сборки отростка бактериофага Т4. Числа соответствуют номерам генов на хромосомной карте фага Т4 (см. рис. 15-19). Буква Р при числе означает, что соответствующий белок непосредственно включается в отросток. Если буква Р отсутствует, значит продукты соответствующих генов в отросток не включаются и играют, по-видимому, каталитическую роль [101, 102].
Изменение конформации белка в результате его взаимодействия с другим белком происходит не только в таких экзотических объектах, как фаги с отростком. Это некий принцип, безусловно играющий важную роль в процессах самосборки микротрубочек, миофибриллярных ансамблей мышцы и многих других более лабильных, но не менее важных каскадных систем, в которых имеют место белок-белковые взаимодействия, например системы, обеспечивающей свертывание крови (рис. 6-16). Формирование мембран также осуществляется за счет самосборки, причем в ходе этого процесса в них должны включаться рецепторы, способные надежно реагировать (хотя и не совсем ясно, каким образом) на химические сигналы, поступающие из окружающей среды. Если посмотреть на все эти процессы с единой точки зрения, то становится ясно, что между белок-белковыми взаимодействиями, которые ведут к образованию небольших белковых агрегатов, и сложными явлениями, разыгрывающимися в интактных клетках в ответ на действие гормонов и других внешних стимуляторов, есть нечто общее.
Вопросы и задачи
1. Примечание: В этой задаче используется константа диссоциации, а не константа образования, с которой мы в основном имели дело в данной главе. Кажущаяся константа диссоциации Ка для иона Н2РО-4 при 25°С и суммарной концентрации фосфата 0,05 М равна 1,380∙10-7 (это соответствует буферу Национального бюро стандартов, представляющему собой раствор 0,025 М КН2РО4 и 0,025 М NaH2PО4) (см. Bates R. G., Determination of pH, 1964).
а. Рассчитайте значение отрицательного логарифма Ка (т. е. рКа). Нанесите полученную величину на кривую зависимости рКа от μ (рис. 3-1).
б. Из выражения для константы диссоциации кислоты на получите логарифмическую форму:
![]()
где а — доля молекул кислоты в ионизированной форме, в. Предположим, что вы хотите приготовить буфер с pH 7,00 при 25 °С из безводных КН2РО4 (мол. вес. 136,09) и Na2HPО4 (мол. вес 141,98). Если Вы насыпали в мерную колбу емкостью 1 л 3,40 г КН2РО4, то сколько безводного Na2HPО4 нужно отвесить перед добавлением воды до метки, чтобы получить раствор с требуемым значением pH? Если Вы хотите получить буфер с pH 7±0,01, то какова должна быть точность навесок солей? Примечание: таким способом можно приготовить буфер с точным значением pH быстрее, чем путем титрования кислотного компонента буферного раствора с помощью NaOH до требуемого значения pH.
2. Кажущееся значение рКа для 0,1 М раствора муравьиной кислоты при 25°С равно 3,7.
а. К 1 л 0,1 М раствора муравьинокислого натрия добавляют концентрированную НСl до тех пор, пока значение pH не станет равным 1,9. Каковы будут концентрации формиат-иона и неионизированной муравьиной кислоты в полученном растворе?
б. Вычислите концентрацию ионов водорода.
в. Сколько эквивалентов НСl пришлось добавить к 1 л 0,1 М раствора муравьинокислого натрия для получения pH 1,9, т. е. в задаче (а)?
3. В мерные колбы емкостью 100 мл поместили по 0,01 моль глицина, а затем добавили указанные ниже количества НСl или NaOH. Колбы заполнили водой до меток и полученные растворы тщательно перемешали, после чего измерили их pH. Исходя из полученных значений pH, вычислите рКа для карбоксильной группы и аминогруппы, произведя при этом столько независимых расчетов рК, сколько позволяют имеющиеся данные. Напомним, что при низких значениях pH необходимо учитывать концентрацию свободных ионов водорода (см задачу 26).
|
колбы |
НСl моль |
NaOH, моль |
pH |
|
1 |
0,010 |
1 ,71 |
|
|
2 |
0,009 |
1 ,85 |
|
|
3 |
0,006 |
2,25 |
|
|
4 |
0,002 |
2,94 |
|
|
5 |
0,002 |
9,00 |
|
|
6 |
0,004 |
9,37 |
|
|
7 |
0,005 |
9,60 |
4. Используя значения рКа, полученные в задаче 3, постройте теоретическую кривую титрования, изображающую зависимость числа эквивалентов Н- и ОН-, реагирующих с 1 молем глицина, от pH. Заметим, что форма такой кривой не зависит от рKа. Постройте аналогичные кривые для глутаминовой кислоты (рKа для которой равны 2,19; 4,25 и 9,67), гистидина (рKа равны 1,82; 6,00 и 9,17) и лизина (рКа равны 2,18; 8,95 и 10,53).
Сравните построенную Вами кривую для глицина с кривой, полученной при добавлении 1 н. кислоты или основания к раствору* содержащему 0,01 моль глицина на 100 мл воды. Сравните также Ваши кривые с кривыми для глицина, приведенными в других учебниках.
5. Ниже приведены уравнения обратимых реакций между алифатическими аминами и формальдегидом.
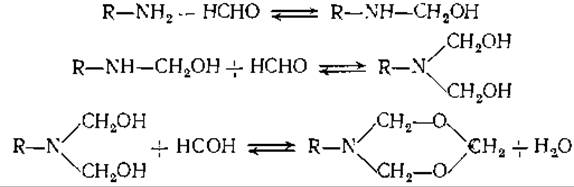
Укажите (в качественной форме), как изменились бы кривые титрования, о которых шла речь в задаче 4, если бы в растворе содержалось 9% формальдегида.
6. Значения рKа для боковых групп аминокислотных остатков в белках иногда немного отличаются от значений, приведенных в табл. 2-2. Чаще всего такие отклонения имеют место в случае «упрятанных» в структуре, т е. недоступных для растворителя групп или же для групп, расположенных очень близко от других ионизированных групп. Попробуйте объяснить следующие факты:
а. Необычно высокое значение рKа для карбоксильной группы остатка аспарагиновой кислоты (гл. 5, разд. В.4.а).
б. Необычно низкое значение рKа для карбоксильной группы остатка аспарагиновой кислоты.
в. Необычно высокое значение рKа для фенольной группы остатка тирозина.
7. Перепишите уравнения (4-20) — (4-25), используя константы диссоциации. Их было бы удобно обозначить через К1, К2, Kа и т. д., но, чтобы избежать путаницы, лучше использовать обозначения К1d, K2d, Kad и т. д.
8. а. Опишите два способа определения или оценки таутомерного отношения R [уравнение (4-21)].
б. Рассчитайте значение рКс для уравнения (4-21) и сравните его со значением рКb* и соответствующим значением рК для фенола. Проанализируйте различия.
9. Молекула имеет два идентичных центра связывания для лиганда Х. Свободная энергия взаимодействия между лигандами, связанными с одной и той же молекулой, е, определяется как изменение свободной энергии связывания лиганда с молекулой, обусловленное связыванием первого лиганда с соседним центром. Покажите, что если степень насыщения ![]() то из уравнения, характеризующего изотерму связывания, следует, что
то из уравнения, характеризующего изотерму связывания, следует, что
![]()
10. На рис. 4.4 приведена кривая связывания иона водорода сукцинатом. Оцените отсюда значение е и микроскопические константы связывания.
11. Линейная молекула имеет очень большое число идентичных центров связывания лиганда X. Свободная энергия взаимодействия между лигандами, связанными с расположенными по соседству друг с другом центрами, равна е. Считается, что взаимодействие между лигандами, не являющимися ближайшими соседями, пренебрежимо мало. Если обозначить константу связывания с центром, расположенным рядом с незанятыми центрами, через Кr, то выражение для изотермы связывания будет иметь вид
![]()
[J. Applequist, J. Chem. Ed. in press (1977).]
Покажите, что при ![]() из приведенного выше соотношения следует, что
из приведенного выше соотношения следует, что
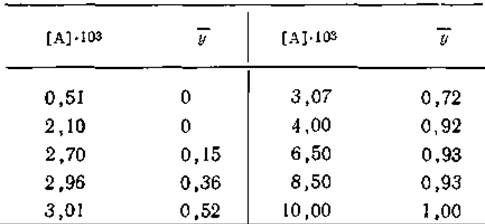
![]()
12. Связывание аденозина с поли(ІІ) было изучено методом равновесного диализа (Huang, Ts’o, JMB, 16, 523, 1966). В приведенной ниже таблице указаны доли занятых центров в молекулах поли(U), т. е. значения ![]() при разных молярных концентрациях свободного аденозина (А) в растворе при 5 С. Определите истинную константу ассоциации для присоединения аденозина к поли (U) и свободную энергию взаимодействия между расположенными по соседству аденозинами при условии, что взаимодействием между аденозинами, не являющимися ближайшими соседями, можно пренебречь. Притягиваются или отталкиваются друг от друга соседние молекулы?
при разных молярных концентрациях свободного аденозина (А) в растворе при 5 С. Определите истинную константу ассоциации для присоединения аденозина к поли (U) и свободную энергию взаимодействия между расположенными по соседству аденозинами при условии, что взаимодействием между аденозинами, не являющимися ближайшими соседями, можно пренебречь. Притягиваются или отталкиваются друг от друга соседние молекулы?