Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Мембраны и клеточные оболочки
Метаболизм и функции мембран
Транспорт молекул через мембраны
Исключительно большое значение имеет способность клеток поглощать питательные вещества и выделять различные соединения. Как уже упоминалось в разд. А.4, небольшие нейтральные молекулы могут проникать через мембраны просто за счет обычной диффузии. Скорость диффузии вещества определяется его растворимостью в мембране, коэффициентом диффузии в мембране (гл. 6, разд. А.7) и разностью концентрации вещества снаружи и внутри клетки. Эту разность называют обычно градиентом концентрации. При транспорте заряженных частиц существенное влияние на процесс диффузии оказывает также разность электрических потенциалов, возникающая в результате накопления в клетке избытка отрицательно заряженных ионов.
Путем обычной диффузии в клетки проникают вода, двуокись углерода, кислород и молекулы анестезирующих веществ. Значительно более широко распространен процесс облегченной диффузии [40]. Подобно обычной диффузии, облегченная диффузия зависит от градиента концентраций — в ходе этого процесса молекулы всегда перемещаются из области с более высокой концентрацией в область с более низкой концентрацией. Для облегченной диффузии характерен эффект насыщения, который заключается в том, что по мере увеличения концентрации диффундирующего вещества (со стороны большей концентрации) скорость потока вещества через мембрану стремится к некоторому максимуму. Эффект насыщения наблюдается также в ферментативных реакциях (гл. 6, разд. А.2), что указывает на некоторые общие черты в механизмах этих двух процессов. Очевидно, при облегченной диффузии транспортируемое вещество соединяется с подвижным переносчиком (чаще всего белком). Переносчик далее диффундирует на короткое расстояние к противоположной стороне мембраны, где освобождается от связанной с ним молекулы или иона. В случае если скорости ассоциации и диссоциации вещества с переносчиком превышает скорость диффузии, перенос молекул может быть описан уравнением Михаэлиса—Ментен (гл. 6, разд А 5), а «кинетические параметры» процесса диффузии, т. е. величины Vmax (максимальная скорость) и Км (константа Михаэлиса), определяются с помощью уравнения (6-15).
Наибольший интерес представляет активный транспорт, при котором вещество переносится через мембрану против градиента концентрации, т. е. из области с более низкой концентрацией в область с более высокой концентрацией. Этот процесс сопровождается увеличением свободной энергии, которое составляет 5,71 lg с2/с1 кДж∙моль-1 [уравнение (3-25)], где с2 и с1 — соответственно более высокая и более низкая концентрации. Это обстоятельство делает необходимым сопряжение процесса активного транспорта с какой-нибудь самопроизвольно протекающей экзергонической реакцией. Такое сопряжение может осуществляться по меньшей мере двумя путями. При первичном активном транспорте имеет место непосредственное сопряжение с реакцией типа гидролиза АТР и «накачиванием» растворенного вещества через мембрану, тогда как при вторичном активном транспорте используется энергия электрохимического градиента, возникающего для другого растворенного вещества. Во втором случае одно растворенное вещество «накачивается» против градиента концентраций, а затем второе переносится через мембрану в результате обмена с первым. Еще одна разновидность активного транспорта известна под названием групповая транслокация [41]. В этом процессе транспортируемое вещество сначала подвергается ковалентной модификации, и образующийся при этом продукт проникает в клетку.
Процессы транспорта, будь то облегченный или активный транспорт, представляются весьма сложными и протекают с участием нескольких мембранных белков. Иногда для описания транспортной системы используют термин пермеаза. В связи с тем что количества белков, вовлеченных в транспорт веществ, незначительны, для изучения транспортных систем были использованы методы генетического анализа. Можно надеяться, что с помощью этих методов удастся определить число генов, детерминирующих белки, которые участвуют в переносе конкретных соединений через мембраны.
а. Связывающие белки
В последнее время достигнуты значительные успехи в выделении связывающих белков, которые принято считать компонентами пермеазных систем. Большая часть этих белков была извлечена с поверхности бактерий разными методами, и в частности путем резкого изменения осмотического давления среды (осмотический шок) [42—44].
Например, если в течение 10 мин клетки Е. coli, суспендированные в 0,5 М сахарозе, обрабатывать раствором ЭДТА (10-4 М), а затем разбавить холодной водой, то из них извлекаются белки, связывающие сахара, аминокислоты, ионы металлов и другие вещества. Один из белков с мол. весом ~ 35 000 специфически связывает галактозу. Локализация связывающих белков в бактериальных клетках точно не установлена Связывающие белки обычно относят к «периплазматическим» (разд. Г), однако они могут быть непрочно связаны с плазматической мембраной.
Связывающие белки подошли бы на роль подвижных переносчиков в процессе облегченной диффузии, однако большая часть выделенных белков принадлежит, по-видимому, к системам активного транспорта, и их функция в процессах переноса до сих пор окончательно не установлена. Согласно одному из предположений, связывающий белок обладает сильным сродством к транспортируемому веществу (субстрату) и прочно связывается с ним на наружной поверхности «летки. Образовавшийся комплекс белок—субстрат далее диффундирует к внутренней істороне мембраны. Здесь в результате процесса, сопряженного с самопроизвольно протекающей экзергонической реакцией, например с гидролизом АТР, конформация белка меняется таким образом, что его сродство к субстрату уменьшается. В результате транспортируемое вещество переходит в клетку, а связывающий белок диффундирует обратно к наружной поверхности. Там его конформация возвращается к исходной, вероятно, под влиянием химических воздействий.
Какие классы молекул и ионов транспортируются через мембраны? Из окружающей среды в клетку поступают неорганические ионы, причем в результате переноса иногда они сильно концентрируются (гл. 2, разд. Е.2). Например, корни зеленых растений могут экстрагировать необходимые вещества из очень разбавленных растворов. Аналогичной способностью наделены микроорганизмы, например дрожжи и бактерии, у которых обнаружены системы, способные избирательно концентрировать многие ионы, в том числе К+, Са2+, сульфаты и фосфаты. Кожа лягушки в состоянии поглощать ионы Na+ из среды с концентрацией NaCl, равной 10-5 М, и переносить их во внутреннюю среду, где концентрация NaCl превышает 0,1 М. Клетки слизистой оболочки желудка могут концентрировать ионы водорода в желудочном соке примерно до 0,16 М.
В клетки животных и бактерий активно транспортируются аминокислоты [38, 39]. У Е. colі существуют специфические системы переноса почти для каждой аминокислоты, а для некоторых аминокислот таких систем даже несколько. Обычно наряду с системой, для которой характерны высокое сродство к аминокислоте и способность «перекачивать» ее из областей с очень низкой концентрацией, существуют параллельно функционирующие системы с рецепторами, не обладающими столь высоким сродством к субстрату. Системы транспорта аминокислот, а также сахаров достаточно хорошо исследованы у бактерий [38, 45, 46]. В одной из таких систем, детально изученной с помощью химических и генетических методов, процесс проникновения различных сахаров (в том числе альдогексоз) внутрь клетки сопряжен с распадом фосфоенолпирувата (табл. 3-5). Судя по всему, сахара при функционировании этой системы проходят через внутреннюю мембрану в виде фоефатных эфиров (групповая транслокация) [46а, 46b]. В другой системе транспорт аминокислот и лактозы сопряжен с системой переноса электронов (гл. 10) в связанной с мембраной окислительно-восстановительной цепи. Считают, что эта система не зависит от синтеза АТР.
Внутриклеточные органеллы имеют собственные системы, концентрирующие ионы. Так, митохондрии могут концентрировать ионы К+, Са2+, Mg2+и других двухвалентных металлов, а также и дикарбоновые кислоты (гл. 10). У митохондрий транспорт многих веществ происходит скорее всего за счет обменной диффузии, т. е. путем вторичного активного транспорта.
б. Генетические аспекты транспорта
У микроорганизмов выявлено огромное число мутаций, которые влияют на их способность изменять поглощение питательных веществ [38]. Здесь мы ограничимся рассмотрением системы, обеспечивающей транспорт калия в Е. coli [45, 47]. Один из мутантов Е. coli нормально живет в 0,1 М растворе К+, но не может существовать при значительно более низких концентрациях этого иона, хотя большинство других штаммов легко переносят такие условия. У штамма Е. coli К 12 обнаружено по крайней мере 6 генов, необходимых для функционирования трех разных систем, обеспечивающих поглощение калия. Две такие системы транспортируют калий внутрь клетки (против градиента концентрации) при сравнительно высоких концентрациях ионов К+ в окружающей среде. Третья система способна «накачивать» ионы К+ в клетку из среды с очень низкой концентрацией: значение, характеризующее полунасыщение системы (Км), составляет приблизительно 10-6 М. Интересно отметить, что если бактерия растет в среде с высоким содержанием К+, то система, характеризующаяся высоким сродством к ионам К+, не активна, т. е. соответствующий ген «выключен» (репрессирован). Однако, если эту бактерию культивировать в среде с очень низкой концентрацией ионов К+, то происходит экспрессия гена и транспортная система начинает функционировать.
Большое число нарушений в системах переноса было отмечено не только у бактерий. У человека описан целый ряд заболеваний, связанных с дефектами мембранного транспорта [48]. При некоторых таких заболеваниях нарушаются реабсорбция веществ в почечных канальцах и процесс всасывания в тонком кишечнике. Например, при цистинурии наблюдается образование камней из цистина в почках и мочевом пузыре. Такие больные выделяют за сутки до 1 г цистина при норме приблизительно 0,05 г. Известны также случаи выделения больших количеств лизина, аргинина и орнитина. Существование подобных наследственных заболеваний свидетельствует о том, что и у человека клетки, подобно бактериальным, обладают способностью концентрировать различные аминокислоты (см. также гл. 14, разд. Б.З) и другие вещества. В клетках почечных канальцев вещества поглощаются на одной стороне клетки (на рис. 1-3 это нижняя часть клетки) и выделяются в кровоток с другой ее стороны. Еще одно хорошо изученное, но очень редко встречающееся нарушение абсорбционных процессов у человека приводит к развитию почечной гликозурии. В этот процесс также вовлечены проксимальные почечные канальцы. Такая аутосомная доминантная мутация может быть неправильно диагностирована как сахарный диабет. В действительности же люди с подобным дефектом чувствуют себя, как правило, хорошо, и это состояние не считают болезнью.
в. Натриевый, калиевый и кальциевый насосы
Почти во всех клетках концентрация натрия сравнительно невелика, тогда как калия — достаточно высока (табл. 5-2, дополнение 5-3). Согласно одной из гипотез [49], цитоплазма по своим свойствам напоминает ионообменные смолы, несущие фиксированные заряды. Ионообменные смолы с большим числом сшивок избирательно связывают определенные ионы. Например, смолы, содержащие остатки сульфокислот, связывают калий, а смолы, содержащие остаток фосфиновой кислоты, — натрий. В пользу этой гипотезы свидетельствуют данные ЯМР, указывающие на изменение времен релаксации протонов внутриклеточной воды и ионов 39К+ и 23Na+ внутри клеток [50]. Однако экспериментальные измерения такого рода очень сложны, и доказательства, полученные с их помощью, оспариваются [51].
Таблица 5-2 Содержание основных ионов (в миллимолях на 1 кг Н2О) в плазме крови человека и внутриклеточной жидкости скелетной мышцы3
|
Ион |
Плазма крови |
Скелетная мышца (внутриклеточная жидкость) |
|
Na+ |
150 |
14 |
|
К+ |
5 |
150 |
|
Mg2+ |
0,9 |
8 |
|
Са2+ |
2,5 |
1 |
|
Cl- |
105 |
16 |
|
НСО3 |
27 |
10 |
|
Белок- |
176 |
50б |
|
Другие анионы8 |
6 |
146 |
а По данным работ Muntwyler Е., Water and Electrolyte Metabolism and Acid-Base Balance, p. 14, Mosby, St. Louis, Missouri, 1968; White A., Handler P., Smith E. L., Principles of Biochemistry, 5th ed, p. 802, McGraw-Hill, New York, 1973; Long C., Biochemist’s Handbook, p. 670, Van Nostrand, Princeton, New Jersey, 1961. Следует иметь в виду, что данные, приводимые для некоторых ионов, могут варьировать в весьма широких пределах.
б Миллиэквиваленты на 1 кг Н2О.
в Фосфаты и другие небелковые анионы.
В настоящее время более общепринятой является не ионообменная гипотеза, а гипотеза существования в клетках ионного насоса, выкачивающего из клеток ионы Na+ и накачивающего в них ионы К+. Для изучения этого процесса были использованы различные методические подходы. Из гигантского аксона кальмара можно, например, удалять всю цитоплазму, а оставшуюся клеточную оболочку заполнять различными ионными растворами. Сходным образом можно заполнить и тени эритроцитов. Наличие переноса ионов внутрь клеток и из клеток в окружающую среду наблюдалось как на указанных выше объектах, так и на различных интактных клетках других типов. Оказалось, что перенос ионов блокируется ингибиторами, например цианидом, который, как известно, нарушает почти все процессы окислительного метаболизма в клетках. Однако блокирование цианидом снимается при добавлении к клеткам АТР или других фосфатных соединений, характеризующихся высоким значением потенциала переноса групп.
Поскольку в клетках эукариот самым активным соединением такого рода является АТР, предполагают, что именно он служит естественным источником энергии при концентрировании ионов. Однако, как указано в разд. а, бактерии (и митохондрии) могут использовать энергию и из других источников.
Поглощение клетками ионов К+ и выделение ионов Na+ специфически блокируется некоторыми сердечными гликозидами. Наиболее часто в этих целях используют уабаин (рис. 12-18). Меченный тритием уабаин связывается с наружной поверхностью клеток, и из данных, характеризующих такое связывание, удается рассчитать число мест перекачки ионов в расчете на одну клетку [62]. В случае эритроцитов оно составляет 100—200 на клетку (или приблизительно 1 место на 1 мкм2), тогда как в клетках HeLa (широко используемая в лабораториях всего мира линия раковых клеток человека, растущих в культуре на протяжении многих лет) число таких мест составляет 105—106 (т. е. ~103 мест на 1 мкм2). В результате дальнейших исследований было установлено, что при избытке ионов Na+ внутри клетки, а ионов К+ во внешнем окружении происходит гидролиз АТР. Скорость гидролиза определяется концентрацией ионов обоих щелочных металлов и числом мест, связывающих уабаин; для этого процесса необходимо наличие ионов магния.
Рассмотренные выше факты привели к концепции, предполагающей, что (Na+ + К+)-зависимая АТРаза и является, по существу, мембранным ионным насосом. Для активации ферментной системы ионы К+ и Na+ должны находиться по разные стороны от мембраны. Вместе с тем очищенный фермент должен гидролизовать АТР в пробирке в присутствии Na+ + K+ + Mg2+. Этот белок удалось выделить в очищенном виде [53—56]. При гель-электрофорезе в присутствии додецилсульфата натрия очищенная (Na++K+)-зависимая АТРаза разделяется на две субъединицы. Большая из них представляет собой полипептидную цепь с мол. весом ~95 000—100 000, а меньшая является гликопротеидом с мол. весом ~ 50 000. Антитела к изолированной большой субъединице связываются с фрагментами мембран, принадлежащими, по-видимому, участкам внутренней поверхности плазматической мембраны [57]. Логично предположить, что гликопротеидная субъединица фермента расположена на наружной поверхности мембраны.
Дополнение 5-В
Ионы щелочных металлов
Несмотря на то что в земной коре натрий и калий присутствуют в примерно одинаковых количествах, все живые клетки накапливают только ионы калияа-в. Оказывается, ионы натрия нужны лишь некоторым морским организмам и многоклеточным животным для регуляции состава жидкостей тела. Большинство неморских растений не проявляет явной потребности в натрии.
Тенденция к накоплению ионов калия интересна в связи с тем, что в морской воде концентрация Na+ составляет ~0,46 М, тогда как К+ — лишь 0,01 М. Другие щелочные металлы в морской воде содержатся в еще меньших количествах; так, например, концентрация Li+равна 0,026 мМ, Rb+— 0,001 мМ, a Cs+содержится в следовых количествах. В грунтовых водах концентрация К+ примерно 0,1 мМ, а Na+— 0,65 мМ, причем известно, что растения также отдают явное предпочтение калию.
Внутриклеточная концентрация К+ меняется от 200 мМ у Е. coli и 150 мМ в мышцах млекопитающих до ~30 мМ у пресноводных беспозвоночных (двустворчатых моллюсков, гидр) и некоторых простейших. У последних обнаружены самые низкие концентрации этого иона. К+ не может быть заменен на Na+, однако обычно возможна частичная замена К+ на Rb+ и в меньшей степени — на Cs+. У некоторых микроорганизмов рубидий может практически полностью замещать калий, и даже крыса может прожить в течение короткого отрезка времени при почти полной замене К+ на Rb. У бурых водорослей большая часть ионов К+ заменена протонамиг. Потребность человека в калии весьма высока; она достигает примерно 2 г/сут. Было высказано предположение, что современное человечество страдает от хронической нехватки калия, возникающей в результате приготовления пищи и варки овощейд.
Натрий также необходим высшим животным. На безнатриевом рационе крысы погибают. Содержание натрия внутри клеток отличается у разных видов животных, однако обычно оно в 5—10 раз меньше содержания калия. В крови отношение обратное: концентрация Na+ в плазме крови человека 0,15 М, а К+ — 0,005 М. Любопытно, что вкус соли в пище один из самых необходимыхб.
Причины избирательности клеток в отношении К+ далеко не очевидны; возможно, все дело в различной степени гидратации ионов К+ и Na+(гл. 4, разд. В.8.б). Эти ионы могут иметь первостепенное значение для обеспечения возбудимости мембран (разд. Б.З) даже у бактерий. Различные концентрации двух данных ионов по разные стороны от мембраны обеспечивают существование легкодоступного источника энергии для многих связанных с функционированием мембран процессов.
Ионы К+ необходимы для функционирования многих внутриклеточных ферментовб,в. К их числу относятся ферменты, катализирующие фосфорилирование карбоксильных групп или енольных анионов, а также реакции элиминирования с образованием енолов.
а Kernan Р. Р., Cell К, Butterworth, London, 1965.
б Suelter С. Н. In: Metal Ions in Biological Systems (Sigel H., ed.), Vol. 3, pp. 201—251, Dekker, New York, 1974.
в Suelter С. H., Science, 168, 789—795 (1970).
г Steinbach H. В., Comp. Biochem, 4, pp. 677—720 (1962),
д Weber C. E., J. Theor. Biol., 29, 327—328 (1970).
e Kaunitz H., Nature (London), 178, 1141—1144 (1956).
Стехиометрические соотношения в натрий-калиевом насосе весьма своеобразны. При распаде каждой молекулы АТР из клетки выкачиваются 3 иона натрия, а извне в клетку накачиваются 2 иона калия. Поскольку из клетки выкачивается больше положительно заряженных ионов, чем попадает в нее, внутри клетки создается избыточный отрицательный заряд. Наличие отрицательного заряда внутри клетки было установлено уже давно путем измерения электрического мембранного потенциала (разд. Б.З). Поскольку клеточная мембрана все же проницаема для ионов К+, возникновение мембранного потенциала приводит к диффузии этих ионов через мембрану внутрь клетки, что обусловливает частичную нейтрализацию отрицательного заряда на мембране. Когда скорость пассивной диффузии уравновешивает мембранный потенциал, образующийся за счет активного транспорта, устанавливается стационарное состояние.
Достоверно установлено, что транспорт Na+ и К+ ионным насосом обеспечивается энергией гидролиза АТР1. Функция (Na++К+)-зависимой АТРазы состоит не просто в гидролизе АТР, и в этом смысле термин АТРаза употребляется не совсем корректно. Процесс расщепления АТР должен быть сопряжен с каким-то конкретным механизмом, обеспечивающим перекачку ионов, который до сих пор остается невыясненным. Сугубо гипотетическая модель такого механизма приведена на рис. 5-3. Предполагается, что белки ионного насоса находятся в двух конформациях. В одной конформации (А) белок прочно связывает 3 иона Na+, а в другой (В)—2 иона К+. АТР играет роль «мотора», осуществляющего конформационные изменения белка, и, кроме того, может принимать непосредственное участие в формировании участков связывания ионов. Изображенный на рис. 5-3 насос встроен в. мембрану таким образом, что большие субъединицы фермента смотрят внутрь клетки, а гликопротеидные субъединицы торчат наружу. В центре (который может быть расположен на поверхности раздела между двумя субъединицами димера, как это показано на рис. 4-9) имеется узкая полость, в которую выступают хелатообразующие группы (например, группа С = О пептидной цепи). Эти группы образуют три связывающих участка для ионов Na+, диаметр которых составляет 0,095 нм. Самопроизвольное связывание ионов натрия запускает реакцию фосфорилирования, в результате которой фосфорильная группа комплекса Mg — ATP2- переносится на группу Y. Фосдорнлирование в свою очередь инициирует переход белка в конформационное состояние В, при котором канал становится открытым с наружной стороны и закрытым — с внутренней. Одновременно уменьшается сродство по отношению к ионам Na+, и эти ионы выходят наружу.
1 Перекачивание ионов натрия и калия является одним из тех клеточных процессов, которые требуют большого количества энергии. Считается, что в покоящихся мышцах на это уходит половина образующегося АТР, а в нервных клетках еще больше. Таким образом, этот процесс составляет весьма существенную долю в общем энергетическом балансе метаболизма (гл. З, разд. А.5).
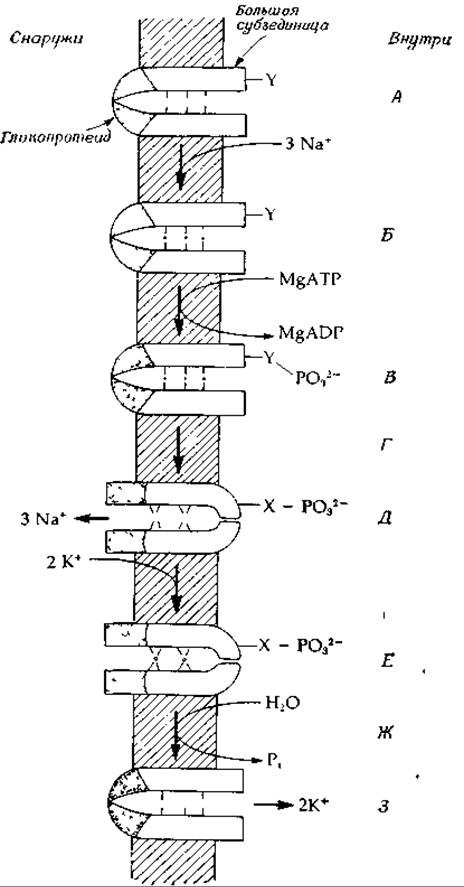
РИС. 5-3. Чисто гипотетическая модель (Na++К+)-иасоса. Открывание и закрывание канала на противоположных сторонах мембраны и чередующееся изменение эффективности связывания Na+ и К+ обеспечиваются энергией гидролиза АТР. А. Конформация А, при которой связывается Na+. Выступающие группы образуют в центральной полости связывающие участки размером 0,1 нм Б. Связано три иона Na+. В. Группа Y фосфорилирована. Возможно, за счет отрицательного заряда ионы Na+ связываются более прочно. Г. Происходит коиформационный переход Фосфорильная группа переходит на другой акцептор — X. Д. Конформация В, при которой связывается К+. Образуются К+-связывающие участки размером 0,13 нм; ионы Na+ диффундируют наружу. Е. Связаны 2 иона калия Ж. За счет гидролиза связи между X и фосфорилом происходит переход в исходную конформацию А. З. Ионы калия диффундируют внутрь клетки
На следующем этапе связываются 2 иона К+. Для конформации В характерно высокое сродство к ионам К+. Обратный переход в конформацию А, сопровождающийся освобождением ионов К+ во внутреннее пространство клетки, инициируется гидролитическим отщеплением фосфорильной группы в виде неорганического фосфата (Р1).
Может возникнуть вопрос, каким образом открытие и закрытие канала синхронизируется с изменениями числа и специфичности участков связывания ионов. Напомним, однако, о тех структурных изменениях, которые происходят при оксигенации гемоглобина (рис. 4-19). Хотя поворот субъединиц друг относительно друга вызывает лишь незначительные изменения в геометрическом расположении групп, выступающих в центральный канал, это обусловливает весьма существенные изменения в связывании 2,3-дифосфоглицерата. Аналогичным образом в нашем случае благодаря незначительным перемещениям могут стать недоступными участки связывания ионов Na+ и сформироваться новые участки связывания для более крупных ионов К+; при этом могут использоваться те же самые группы, способные к образованию хелатных комплексов, что и в случае с Na+.
Вопрос о том, каким образом фосфорилирование вызывает конформационные изменения, рассмотрен в гл. 7, разд. Е.5. Поскольку перенос фосфорильного остатка между различными боковыми группами белка вполне возможен, вероятно, именно он обусловливает конформационный переход А→В; это показано на рис. 5-3 (перенос фосфорильной группы с Y на X).
Химическая природа участков связывания ионов Na+ и К+ в ионном насосе неизвестна. Однако некоторые соображения на этот счет позволяют высказать данные, полученные при изучении антибиотиков пептидной природы, многие из которых связывают ионы металлов и катализируют их диффузию через мембраны [58]. Примером соединения такого рода может служить циклический депсипептид (пептид, который наряду с амидными содержит также и сложноэфирные связи) — валиномицин. В состав этого антибиотика входят остатки D- и L-валина, L-молочной кислоты и D-оксиизовалериановой кислоты.

Включение такого ионофора в состав искусственной мембраны при инкубации в К+-содержащей среде приводит к резкому увеличению проводимости мембраны1. Была тщательно исследована структура валиномицина [58, 60—63а]. Показано, что при связывании с ионом калия молекула приобретает более компактную конформацию. Изменение конформации происходит в результате разрыва двух водородных связей и образования новых водородных связей, что сопровождается «свертыванием» молекулы вокруг иона калия (рис. 5-4). Перенос калия при помощи валиномицина происходит пассивно, однако он сопровождается, как это видно, циклическими переходами между двумя, конформациями переносчика, когда он проходит через стадии взаимодействия с ионом, диффузии через мембрану и освобождения иона с противоположной стороны мембраны. Скорость такого переноса чрезвычайно велика — каждая молекула валиномицина способна переносить через мембрану приблизительно 104 ионов калия в 1 с. Поэтому даже очень незначительные количества ионофора могут вызвать очень сильные изменения проницаемости и проводимости мембраны.
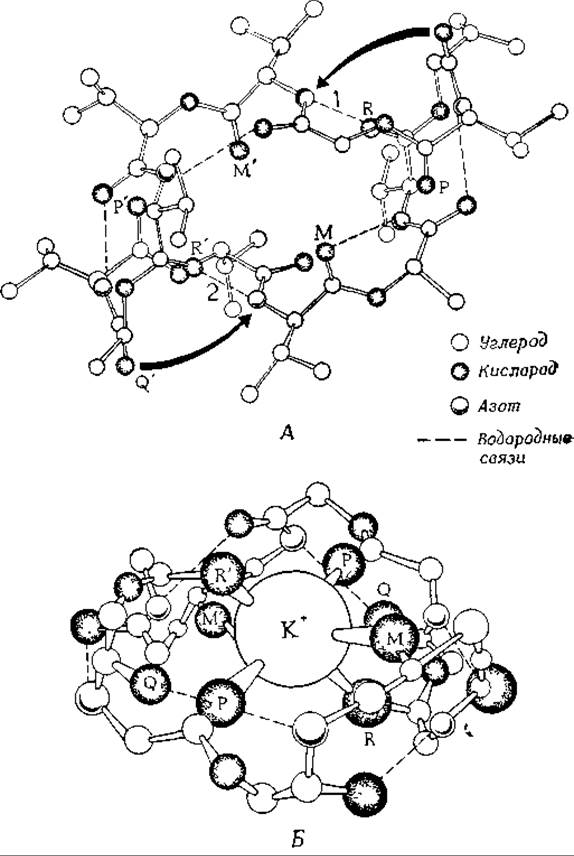
РИС 5-4. Строение свободного валиномицина (А) и его комплекса с К+ (Б). Предполагают, что экспонированные атомы кислорода Р, Р', М и М' карбонильных груш» образуют исходный комплекс с К+ Затем водородные связи 1 и 2 разрываются, что позволяет кислородным атомам R и R' также принять участие в связывании ионов К+ (в результате образуется 6 координационных связей). «Свертывание» молекулы, вызванное связыванием иона К+, сопровождается небольшими конформационными перестройками. Благодаря этому атомы кислорода Q и Q' завершают образование внутримолекулярных водородных связей в К+-содержащем комплексном ионе (Duak et al, Science, 176, 911, 1972, copyright 1972 by the American Association for the Advancement of Science.)
1 Следует отметить, что нет никаких доказательств того, что эти антибиотики играют аналогичную роль в спорулирующих клетках, в которых они синтезируются. Предполагают, что бацитрацин обладает способностью повышать скорость диффузии, ионов Мn2+ через мембраны [59].
Дополнение 5-Г
Антибиотики
Многие организмы продуцируют химические вещества, токсичные для других организмов. Корни или листья некоторых растений секретируют соединения, блокирующие рост других растений. Нам более знакомы используемые в медицине антибиотики, продуцируемые грибами и бактериями. О способности одних организмов ингибировать рост других было хорошо известно уже в прошлом столетии, однако широкий интерес к этой проблеме возник лишь в 1929 г., когда Александр Флеминг обнаружил, что Penicillium notation ингибирует рост стафилококков. Это наблюдение непосредственно привело к выделению пенициллина, который был впервые использован для лечения больных в 1941 г. Несколькими годами позже Ваксман выделил из почвенных актиномицетов (стрептомицетов) актиномицин (дополнение 15-Б) и стрептомицин (дополнение 12-А); он же предложил для. этих соединений название антибиотики. Применение стрептомицина оказалось эффективным при лечении туберкулеза. Это открытие стимулировало поиски других веществ с аналогичными свойствами. С тех пор каждый год открывают примерно 50 новых антибиотиков. Уже налажено производство более 60 антибиотиков.
Известны следующие основные классы антибиотиков: 1) пептиды типа грамицидинов и тироцидинов (их известно более 200); 2) пенициллин и цефалоспорины (дополнение 7-Г); 3) тетрациклины (рис. 12-10); 4) макролиды, макроциклические лактоны, такие, например, как эритромицины (рис. 12-10); 5) полиеновые антибиотики (рис. 12-10).
Как действуют антибиотики? Некоторые, подобно пенициллину, блокируют работу определенных ферментов (дополнение 7-Г). Пептидные антибиотики (разд. Б.2.в) часто образуют комплексы с ионами металлов и нарушают, по-видимому, регуляцию ионной проницаемости в мембранах бактерий. Полиеновые антибиотики влияют на транспорт протонов и ионов в мембранах грибов. Тетрациклины, так же как многие другие антибиотики, нарушают непосредственно синтез белка (гл. 15, разд. В.2 з). Некоторые другие антибиотики встраиваются в молекулы ДНК (гл. 2, разд. Г.9; дополнение 15-Б). Таким образам, единого механизма действия для всех антибиотиков нет. Поиск необходимого антибиотика состоит в выборе соединения, обладающего высокой токсичностью для носителя инфекции, но малотоксичного для клеток человека.
Нуждаемся ли мы в новых антибиотиках? Да. Необходимы более эффективные антибиотики против грамотрицательных бактерий типа Salmonella, которые вызывают иногда тяжелые инфекционные заболевания. Современные противогрибковые препараты не удовлетворяют нашим требованиям, очень нужны более эффективные антибиотики против простейших. Поиск антибиотиков среди смешанных популяций микробов почв, болот и озер, бесспорно, будет продолжаться. Однако, по мнению Перлмана, все более возрастающее значение для получения новых, более эффективных антибиотиков будет приобретать химическая модификация уже известных антибиотиков. Сейчас полусинтетические пенициллины играют важную роль в медицине, а химическая модификация антибиотиков типа рифамицина (дополнение 15-А) привела к появлению нового ряда эффективных лекарственных препаратов.
а Perlman D. In: Medicinal Chemistry (A. Burger, ed.), 3rd ed., Part I, pp. 305—370. Wiley, New York, 1970.
Уникальное свойство валиномицина состоит в его способности образовывать с калием значительно более стабильные комплексы, чем с натрием. Это позволяет считать валиномицин специфическим ионофором для калия. При добавлении к суспензии митохондрий он включается в мембраны и специфически ускоряет поглощение ионов калия1. В отличие от валиномицина выделенный из грибов пептид антаманид (дополнение 15-В) избирательно связывает не ионы калия, а ионы натрия, что обусловлено различиями в геометрии связывающих участков. Строение Nа+-антаманидного комплекса показано на рис. 5-5. Другой ионофор, о котором шла речь в гл. 2, энтеробактин (рис. 2-44), служит переносчиком железа. Заметим, что и в этом случае связывание иона металла также сопровождается значительными конформационными изменениями пептида. Предполагают, что роль ионофоров могут играть некоторые фосфолипиды [64а].
Ионы кальция также активно выкачиваются из большинства клеток при помощи системы, напоминающей во многих отношениях (Nа++К+)-зависимую АТРазу [65, 66]. Из слизистой кишечника был выделен белок, связывающий кальций, синтез которого зависит от витамина D [14, 67] (дополнение 5-Д). Этот белок имеет большой молекулярный вес и сходен с мышечным кальций-связывающим белком (гл. 4, разд. В.8.в).
Вполне возможно, что существуют транспортные системы и для многих других ионов. Единственный ион, который, по-видимому, не переносится активно, — это ион хлора. Мембраны относительно проницаемы для этих ионов (разд. А.6), которые являются основными анионами плазмы (табл. 5-2).
1 При добавлении валиномицина к суспензии клеток Streptococcus faecalls отношение [К+]внутри/[К+]снаружи быстро уменьшается [64]. Считают, что антибиотическая активность валиномицина объясняется выходом из клеток ионов К+ (или Rb+).
В большинстве случаев ионы хлора распределяются пассивно в соответствии с уравнением Доннана [68, 69]:
[К+]в[Сl-]в = [К+]н[Сl-]н. (5-1)
Индексы «в» и «н» означают, что концентрации относятся соответственно к внутренней и наружной сторонам клеточной мембраны. Из уравнения (5-1) следует, что, поскольку концентрация ионов калия в клетке поддерживается на высоком уровне благодаря работе (Na+ + К+)-насоса, в присутствии не способных к диффузии анионов концентрация ионов хлора внутри клетки должна быть низкой. В соответствии с постоянством произведения концентраций ионов с наружной стороны клетки, где концентрация K+ невелика, концентрация Сl- должна быть высокой.
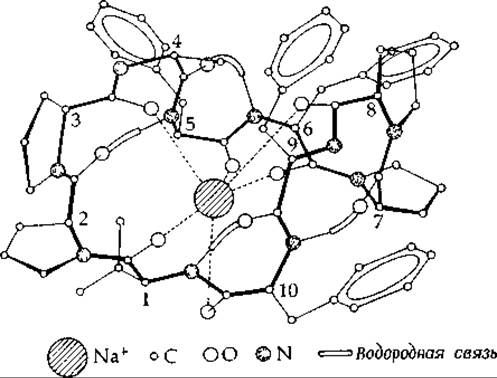
РИС. 5-5. Предполагаемое строение комплекса Na+ — антаманид [601.