Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Как мы изучаем структуру молекул
Гидролиз
Почти все биополимеры по своей природе нестабильны и в реакции с водой распадаются на мономерные звенья (гидролизуются). Гидролиз катализируют протоны, ионы гидроксила и ферменты. Механизмы гидролиза рассматриваются в гл. 7. Гидролиз может быть полным или частичным, неспецифическим или, напротив, направленным на определенные связи в молекуле полимера.
Полный гидролиз белков обычно проводят путем нагревания при температуре около 110° в атмосфере N2 в присутствии 6 н. НСl в течение 12—96 ч. Некоторые аминокислоты, в особенности триптофан, при этом разрушаются. По существу, методика проведения идеального полного гидролиза отсутствует1. Полный гидролиз белков можно осуществить с помощью основных катализаторов, но при этом наблюдается значительная рацемизация аминокислот.
Нуклеиновые кислоты тоже гидролизуют сильной кислотой. Например, нагревания в течение 1 ч при 100 °С в 12 н. хлорной кислоте достаточно для расщепления молекулы до составляющих ее оснований. В ДНК N-гликозидные связи более лабильны, чем в РНК, связи с пуринами более лабильны, чем с пиримидинами. Последнее обстоятельство позволяет провести весьма полезную операцию: если оставить ДНК на ночь на холоду при pH2, произойдет полная ее апуринизация. Образующийся полимер известен как апуриновая кислота (табл. 2-11).
Щелочной гидролиз РНК дает смесь 2'- и 3'-нуклеотидов. Механизм этого процесса связан с участием свободных 2'-ОН-групп рибозы и образованием циклических 2',3'-фосфатов и аналогичен механизму действия панкреатической рибонуклеазы (гл. 7, разд. Д.2). Поскольку у дезоксирибозы нет свободной 2'-ОН-группы, ДНК в щелочной среде не разрушается.
Ферментативные методы гидролиза особенно ценны благодаря присущей им во многих случаях специфичности. Трипсин, представляющий собой так называемую эндопептидазу, быстро расщепляет пептидные связи лишь в том случае, если карбонильная группа расщепляемой амидной связи принадлежит одной из основных аминокислот — лизину или аргинину. Таким образом, трипсин превращает белок в сравнительно малое число триптических пептидов, которые можно разделить и охарактеризовать. Трипсин расщепляет только денатурированные белки, причем для получения хороших результатов нужно предварительно разорвать дисульфидные мостики.
1 Недавно сообщалось, что лучшие результаты дает полный гидролиз в 4-N-метан-сульфоновой кислоте в присутствии 3-(2-аминоэтил)-индола [131а].

Таблица 2-11 Некоторые реакции гидролитического расщепления олигонуклеотидов3
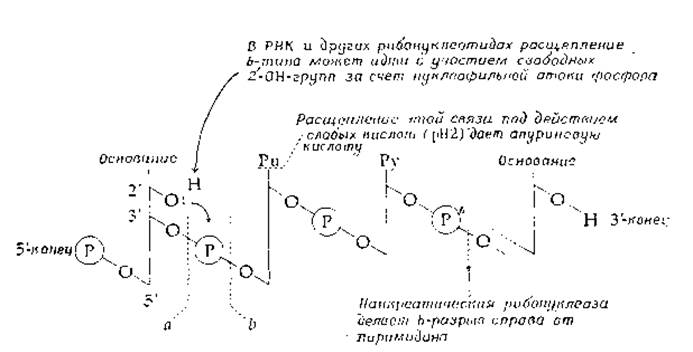
А. Расщепление в точках а осуществляется:
1. Эндонуклеазами (по всей длине молекулы)
Панкреатическая дезоксирибонуклеаза I
2. Экзонуклеазами (только с 3'-конца)
Неспецифическая диэстераза змеиного яда, атакует ДНК и РНК. Реакция идет с обязательным участием свободной 3'-ОН-группы
Б. Расщепление в точках b осуществляется:
1. Случайным образом вдоль всей молекулы эндонуклеазами и щелочами (неферментативный гидролиз)
Панкреатическая рибонуклеаза расщепляет цепь только справа от пиримидинсодержащих нуклеотидов
Рибонуклеаза T1 из Aspergillus oryzae расщепляет цепь справа от гуаиинсодержащих остатков (3'-гуанилат)
Рибонуклеаза Т2 из Aspergillus oryzae расщепляет цепь справа от аденинсодержащих остатков (3'-аденилат)
Панкреатическая дезоксирибонуклеаза (ДНКаза) II Микрококковая ДНКаза
2. Экзонуклеазами (только с 5'-конца)
Фосфодиэстераза из селезенки быка гидролизует как полирибо-, так и полидезоксирибонуклеотиды
а В таблицу включены реакции, затрагивающие как РНК, так и ДНК
6 Символ Р в кружочке здесь означает группу—PO-2—.
Другие ферменты, например химотрипсин и пепсин (гл. 7, разд Г.2), менее избирательны, но все же их тоже можно использовать для расщепления пептидной цепи на фрагменты с последующим определением структуры этих фрагментов. Для установления полной аминокислотной последовательности белка нужно найти «перекрывающиеся» фрагменты, содержащие последовательности, в которые входят концы двух разных триптических фрагментов. Таким путем можно «выстроить» пептиды в том порядке, в котором они расположены в нативном белке.
Рассмотрим теперь метод пептидных карт. Его первый этап состоит в разрыве дисульфидных связей, далее белок денатурируют и расщепляют ферментами, например трипсином или пепсином. В результате получается набор пептидов, размер и аминокислотный состав которых характерен для каждого отдельного белка. Смесь пептидов наносят на лист хроматографической бумаги и проводят в одном направлении хроматографию, а в другом — электрофорез. Пептиды локализуются в виде отдельных пятен, образуя характерную картину («отпечатки пальцев»), Метод пептидных карт особенно полезен для выявления малых различий в структуре белка, например различий между генетическими разновидностями одного и того же белка (рис. 4-20).
Некоторые ферменты катализируют последовательное отщепление аминокислот с одного или другого конца пептидной цепи. Карбоксипептидазы отщепляют аминокислоты с карбоксильного конца, а аминопептидазы атакуют противоположный конец. Используя хроматографические методы, можно определить, какие аминокислоты были отщеплены этими ферментами в заданные моменты времени, и получить представление о последовательности аминокислот на концах цепи.
Полное ферментативное расщепление белков проводят с помощью смеси ферментов, которую составляют протеазы, синтезируемые грибами (проназы). Однако ферменты смеси расщепляют еще и друг друга, так что в общем случае для количественного расщепления белка на составляющие его аминокислоты ферментативный гидролиз не годится. Один из новых методов основан на применении гидролитических ферментов, иммобилизованных на колонках с агаровым гелем. Гидролизуемый белок пропускают через гель, после чего на дне колонки скапливаются составляющие его аминокислоты [132].
Экзонуклеазы отщепляют нуклеотиды с концов полинуклеотидных цепочек, в то время как эндонуклеазы делают разрывы внутри цепи. Одни из них гидролизуют лишь одноцепочечные молекулы, другие — двухцепочечные. Некоторые нуклеазы разрывают обе цепи ДНК, тогда как другие «надрезают» молекулу, внося разрыв лишь в одну из цепей. Специфичность ряда нуклеаз отражена в табл. 2-11. Частичный ферментативный гидролиз РНК дает расщепление молекулы на короткие нуклеотидные последовательности, позволяющие далее определить полную последовательность РНК. (Первой РНК, для которой установлена последовательность, была аланиновая тРНК. Расщепление проводили с помощью панкреатической рибонуклеазы и рибонуклеазы Т1 [133]. Очень полезным методом получения нуклеотидных карт оказался двумерный электрофорез в полиакриламидном геле [134].
Дополнение 2-В
Изотопы в биохимических исследованиях
Как стабильныеa, так и радиоактивные б-г изотопы широко используются в химических и биологических исследованиях. Введение изотопных меток произвело целую революцию в изучении метаболизма. В одном из первых биологических экспериментов, основанных на использовании стабильного изотопа 15N (регистрируемого масс-спектрометрически), Шенгеймер с сотрудниками в 1937 г. обнаружили неожиданно высокую скорость обновления белков в живых тканях (гл. 14, разд. Б). Используя 14СО2, Кэлвин и др. впервые проследили путь углерода в процессе фотосинтеза (дополнение 11-А). Аналогичным образом применение изотопов 32Р и 35S позволило изучить метаболизм фосфора и серы; тритий (3Н) нашел широкое применение для мечения разнообразных органических соединений, например тимина. Использование радиоактивных изотопов лежит в основе чувствительных аналитических методов, к числу которых относится радиоиммуноанализ гормонов, присутствующих в микроколичествах (дополнение 16-А). В рамках приложений, которые находит радиоавтография, изотопы облегчают проведение многочисленных аналитических исследований (см. прилагаемый снимок) и составляют основу ценного метода определения концевых групп, выявляющего последовательность нуклеотидов (рис. 2-37).
|
Энергия излучения, МэВ |
|||
|
Изотоп |
Период полураспада |
β |
у |
|
2Н (дейтерий) |
Стабильный |
||
|
3Н (тритий) |
12,26 года |
0,018 |
|
|
13С |
Стабильный |
||
|
14С |
5760 лет |
0,159 |
|
|
15N |
Стабильный |
||
|
18О |
» |
||
|
22Na |
2,6 года |
0,54 |
1,28 |
|
32Р |
14,3 дня |
1,17 |
|
|
35S |
87,2 дня |
0,167 |
|
|
38Cl |
4∙105 лет |
0,716 |
|
|
40К |
1,4∙109 лет |
1,4 |
1,5 |
|
45Са |
152 дня |
0,255 |
|
|
59Fe |
45 дней |
0,467 |
7,70 |
|
85Zn |
250 дней |
0,32 |
1,14 |
|
90Sr |
25 лет |
0,54 |
|
|
125I |
60 дней |
0,035 |
0,030 |
|
131І |
8,07 дня |
0,606 |
0,365 |
Различие в массе изотопов, особенно при переходе от 1Н к 2Н и далее к 3Н, часто сильно влияет на скорости реакций; проводимое на этой основе изучение кинетических изотопных эффектов позволило лучше понять механизм многих ферментативных реакций и все детали их стереохимии. Ярким примером тому служит синтез и дальнейшее использование хирального ацетата (гл. 7, разд. К. 2.ж). За эти исследования Дж. В. Корнфорт в 1975 г. был удостоен Нобелевской премииe. Специфические свойства изотопов лежат в основе ЯМР-спектроскопии (разд. И).
Некоторые из изотопов, нашедших широкое применение в биохимии, указаны в приведенной выше таблице. Для радиоактивных изотопов даны периоды полураспада, а также тип испускаемых частиц и их энергия. Лучи, испускаемые, например, при распаде 125I и 131I, обладают сильной проникающей способностью; их интенсивность, как и интенсивность сильного ß-излучения изотопа 32Р, очень легко определить. Другой изотоп, 3Н (тритий), регистрировать гораздо труднееж, однако испускаемая им слабая ß-частица с малой длиной пробега делает тритий уникальным для использования в микрорадиоавтографии. Зная период полураспада данного изотопа (уравнение 6-4), можно определить то его количество, которое необходимо для получения данной скорости распада; это имеет важное практическое значение, поскольку позволяет найти, какое число распадов в минуту необходимо иметь, чтобы вести счет импульсов с достаточно малой статистической ошибкой. Радиоактивность, при которой в 1 с происходит 3,7∙1010 распадов (такова радиоактивность 1 г чистого радия, 0,3 мг изотопа3Н или 0,22 г изотопа 14С) составляет один кюри (Ки). Один милликюри (мКи) — это 2,22∙109 расп.∙мин-1. Меченое соединение обычно содержит сравнительно мало радиоактивного изотопа по сравнению со стабильным изотопом того же элемента. Радиоактивные препараты характеризуют их суммарной радиоактивностью, выражаемой в милли- или микрокюри, и удельной активностью — мКи∙ммоль-1. Например, если соединение содержит в каком-то одном положении изотоп 3Н и обладает удельной активностью 50 мКи∙ммоль-1, то 3Н содержится в этом положении в количестве 0,17%.

Радиоавтограмма, иллюстрирующая разделение белков Escherichia coli с включенными в них 14С-аминокислотамид. 25 мкл образца (180 000 имп∙мин-1), содержащего ~10 мкг белка, нанесли на колонку с полиакриламидным гелем (размер колонки 2,5X130 мм) и провели изоэлектрическое фокусирование (разд. З.1.е). В результате белки разделились в соответствии с их изоэлектрическими точками. Затем гель извлекли из колонки и поместили на край пластинки из полиакриламидного геля. Последующи электрофорез в растворе додецилсульфата натрия в перпендикулярном направлении привел к разделению белковых молекул по размерам. На радиоавтограмме, полученной наложением на пластинку геля фотографической пленки (в течение 875 ч), можно различить свыше 1000 пятен.
а Matwiyoff N. А.. Ott D. G., Science, 181, 1125—1132 (1973).
б Wang С. Н., Willis D. LLoveland W. D., Radiotracer Methodology in the Biological, Environmental and Physical Sciences, Prentice-Hall, Englewood Cliffs, New Jersey, 1975.
в Wang У. Ed., Handbook of Radioactive Nuclides, The Chemical Rubber Co., Cleveland, Ohio, 1969.
r Thornburn С. C., Isotopes and Radiation in Biology, Butterworth, London, 1972.
д O’Farrell P. H., JBC, 250, 4007—4021 (1975).
e Cornforth J. W., Science, 193, 121 —125 (1976).
ж Bransome E. D., Jr. ed., Liquid Scintillation Counting, Grune and Stratton, New York, 1970.
Методы определения нуклеотидных последовательностей ДНК разрабатывались медленнее, и тем не менее к настоящему времени они уже достаточно хорошо освоены [134а]. Разрыв молекулы ДНК вблизи участка с определенной последовательностью (обычно палиндромной, разд. Г.11) осуществляют с помощью специфических эндонуклеаз рестрикции (гл. 15, разд. Е.1). Полученные фрагменты далее подвергают депуринизации или обрабатывают экзонуклеазами [135]. Отличные результаты дает электрофорез на ацетате целлюлозы с последующим применением особой тонкослойной «гомохроматографии»1 на ДЭАЭ-целлюлозе [136]. Если олигонуклеотиды несут радиоактивную метку на одном конце, последовательность можно определить, частично гидролизуя их с помощью экзонуклеазы (см. следующие параграфы) и проводя затем электрофорез и гомохроматографию (рис. 2-37). Наименьший по длине олигонуклеотид в ходе гомохроматографии продвигается дальше всех; каждое из следующих расположенных ниже пятен отвечает соединению, содержащему на один нуклеотид больше, чем предыдущее. По смещению одного пятна относительно другого в ходе электрофореза можно восстановить примерную нуклеотидную последовательность [137, 137а]. Так, на рис. 2-37 самое верхнее пятно отвечает олигонуклеотиду неизвестного состава, а нуклеотид, находящийся непосредственно ниже его, содержит на один остаток тимина больше, о чем ясно свидетельствует его более высокая электрофоретическая подвижность при pH 3,5. Присоединение гуанина увеличивает электрофоретическую подвижность не так сильно, а присоединение аденина почти совсем на нее не влияет. Присутствие лишнего цитозина, напротив, снижает электрофоретическую подвижность. Последовательность может быть прямо считана с нуклеотидной карты: (5')-TTATTAGCCAGAAGT-(3'). Эти данные были подтверждены дальнейшими исследованиями, в ходе которых проводилось отщепление пуринов и определение ближайших соседей. Другой недавно разработанный метод быстрого определения последовательности ДНК описан в работе [137b].
Существует целая группа специфических ферментов, расщепляющих полисахариды. Обычно эти ферменты специфичны по отношению к какому-то конкретному сахару, встроенному в цепь с помощью определенного типа гликозидной связи. Примерами такого типа являются ферменты, расщепляющие крахмал. а-Амилазы из слюны и поджелудочной железы разрывают молекулы крахмала случайным образом, тогда как растительные ß-амилазы последовательно отщепляют мальтозу с концов неразветвленных цепей (гл. 7, разд. В.6).
1 Разделение меченых олигонуклеотидов проводят в растворителе, содержащем произвольную смесь немеченых нуклеотидов (продукты гидролиза РНК). В ходе проявления пластинки немеченые нуклеотиды становятся на место исследуемых меченых нуклеотидов и перемещаются вдоль пластинки на расстояния, примерно соответствующие их размерам.
Сложные липиды расщепляются липазами. Панкреатическая липаза удаляет 1- и 3-ацильные группы триглицеридов с образованием 2-моноглицеридов. Фосфолипаза А, присутствующая в различных тканях и бактериях, а также входящая в состав змеиного яда, избирательно отщепляет от фосфолипидов ацильную группу, стоящую в 1-м или 2-м положении. В бактериях и растительных тканях присутствуют фосфодиэстеразы, известные под названием фосфолипаз С и D соответственно; они разрывают цепь по разные стороны от фосфодиэфирной связи, как показано ниже.

РИС. 2-37. Двумерная нуклеотидная карта, полученная в результате частичного гидролиза 32Р-олигонуклеотида, отщепленного от кольцевой копии ДНК, синтезированной на цепи глобнновой мРНК (гл. 15, разд. Ж-4). Олигонуклеотид обрабатывали экзонуклеазой из змеиного яда (фосфодиэстеразой, табл. 2-11), отщепляющей нуклеотиды последовательно с 3'-конца. Самое верхнее пятно соответствует нуклеотиду неизвестного состава; каждое следующее расположенное ниже пятно содержит на одно нуклеотидное звено больше. По относительной подвижности промежуточных продуктов (см. текст) была восстановлена последовательность: (5')-ТТATTAGCCAGAAGT-(3') [137].
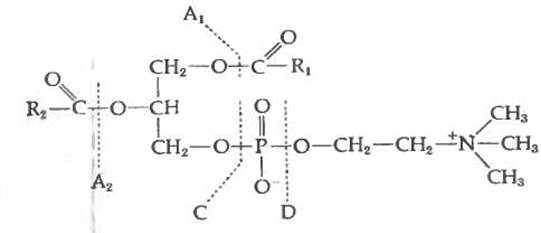
Для избирательного расщепления карбоксилатных эфиров (в положениях, обозначенных на схеме через A1 и А2) используется мягкий гидролиз в присутствии основных катализаторов. Получающиеся в результате фосфодиэфиры, амиды (сфинголипиды) и эфиры можно разделить и идентифицировать.