Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Как мы изучаем структуру молекул
Избирательное расщепление химических связей
В руках химиков, занимающихся определением структуры различных соединений, имеется множество самых разных химических реагентов, как подобранных эмпирическим путем, так и специально синтезированных. Здесь мы рассмотрим лишь немногие из них.
а. Разрыв дисульфидных мостиков в молекулах белков
Прежде чем проводить расщепление полипептидной цепи, обычно сначала разрывают дисульфидные мостики [138—141]. Для этой цели можно использовать три реакции [см. уравнения (2-20) — (2-22) ]. При работе с рибонуклеазой использовалось окисление надмуравьиной кислотой:
![]()
Однако этот метод не нашел широкого применения, поскольку надмуравьиная кислота окисляет также остатки триптофана. Свои недостатки имеет и расщепление мостиков в присутствии сульфита:
![]()
Вероятно, лучшим из трех методов является восстановление дитиотреитолом или дитиоэритритолом:

Эти два дитиола при окислении циклизуются, давая устойчивые дисульфиды. Указанные реагенты оказываются полезными не только для разрыва дисульфидных мостиков в белках, но и для защиты имеющихся в ферментах SH-групп от случайного окисления кислородом. Для той же цели используется и меркаптоэтанол HS—СН2—СН2—ОН, но обычно он несколько менее эффективен.
После того как дисульфидные мостики разорваны, необходимо предотвратить их воссоединение, для чего надо перевести образующиеся тиоловые группы в устойчивые производные. Обычно для этой цели используют иодацетат или иодацетамид:
![]()
Еще лучшим реагентом является акрилонитрил:
![]()
б. Реагенты, избирательно расщепляющие пептидные цепи
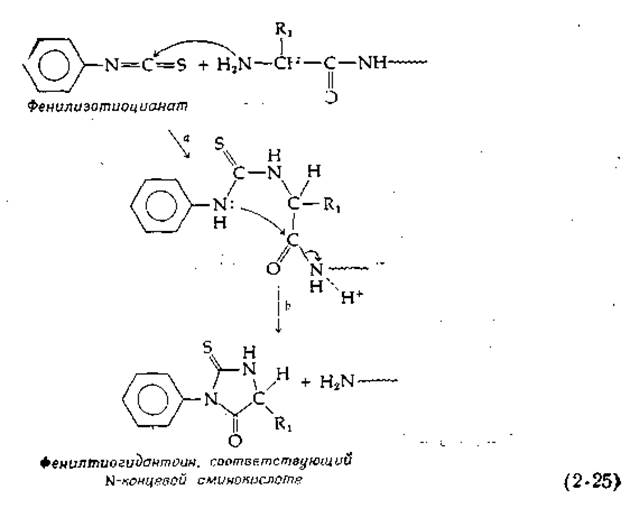
Одним из самых денных реагентов при работе с белками является фенилизотиоцианат, впервые примененный П. Эдманом. Это соединение реагирует с N-концевой аминогруппой пептидов [уравнение (2-25)]. Образующийся продукт циклизуется, что в кислой среде влечет за собой разрыв пептидной цепи (2-25). В итоге образуется соответствующий N-концевой аминокислоте фенилтиогидантоин, который можно идентифицировать. Проделав ту же операцию с укороченной указанным путем пептидной цепью, можно определить следующий аминокислотный остаток. При тщательной постановке эксперимента с помощью реакции Эдмана можно «пройти» вдоль пептидной цепи несколько десятков остатков. Есть специальные приборы — так называемые секвенаторы, в которых все необходимые операции осуществляются автоматически.
Существует множество других реагентов, расщепляющих пептидные связи внутри цепи в специфических местах [138]. Особенно ценен бромциан, N = C—Br, разрывающий цепь вслед за остатками метионина. Как показывает уравнение (2-26), сера метионина замещает ион брома. Пространственная конфигурация образующегося сульфониевого соединения благоприятствует разрыву С—S-связи, протекающему с участием соседней пептидной группы. Гидролиз связи C = N в полученном продукте обусловливает разрыв пептидной цепи (уравнение 2-26).
Обработка гидроксиламином при высоких значениях pH часто приводит к избирательному разрыву связей Asp—Gly. Возможный механизм этого процесса обсуждается в работе [142].