Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Как мы изучаем структуру молекул
Методы, основанные на включении метки в концевые звенья
В 1957 г. Ф. Сэнгеру за определение первичной структуры инсулина была присуждена Нобелевская премия по химии. Это был первый белок, для которого удалось установить аминокислотную последовательность; этой работе Сэнгер посвятил 10 лет. В основе его подхода лежал частичный гидролиз пептидных цепей, предварительно помеченных:

в ходе реакции свободной аминогруппы с фтординитробензолом [уравнение (2-27)].
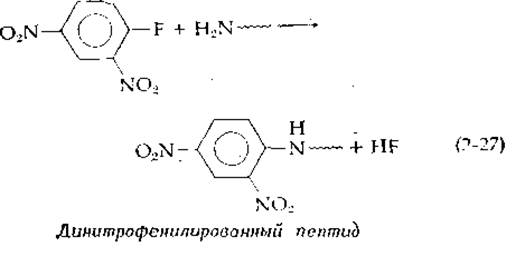
Связь с динитрофенилыюй группой устойчива к кислоте, и поэтому после полного кислотного гидролиза меченого пептида высвобождалась динитрофенилированная аминокислота (соединение, имеющее желтую окраску), которая находилась ранее на N-конце цепи. Кроме того, Сэнгер использовал меченые ε-аминогруппы остатков лизина. Частичный, кислотный гидролиз меченых пептидов приводил в этом случае к образованию небольших фрагментов, для которых затем определяли аминокислотный состав. В конце концов Сэнгер сложил фрагменты полученной аминокислотной мозаики и установил последовательность двух цепей молекулы инсулина, содержащих 21 и 30 остатков и связанных между собой в цельной молекуле дисульфидными мостиками (рис. 4-13) В последние годы вместо фтординитробензола чаще применяют дансил-хлорид. Получающиеся в результате пептидные производные сильно флуоресцируют, что позволяет проводить анализ концевых групп со значительно меньшим количеством пептидов.

Существует ряд способов маркировки SH-группы боковых цепей белка. Один из наиболее распространенных основан на использовании реагента Элмана — 5,5'-дитиобис-(2-нитробензойная кислота), ДТНБ [уравнение (2-28)].

Этот реагент количественным образом взаимодействует с —SH-гpyппами, образуя смешанные дисульфиды и высвобождая тиоловый анион, поглощающий свет при 412 нм, что позволяет определить содержание —SH-групп в белке. При этом, к сожалению, могут параллельно протекать дисульфидные обменные реакции с участием дополнительных молекул ДТНБ, приводящие к разрыву дисульфидных связей в белке [143]. Помимо указанных выше, имеется множество других реагентов, позволяющих модифицировать разные боковые группы в молекуле белка [138, 143а].
В случае углеводов классическим методом идентификации концевых групп служит исчерпывающее метилирование. Многократная обработка метилирующим реагентом, например диметилсульфатом, превращает все свободные ОН-группы в ОСН3-группы. Полный кислотный гидролиз с последующим разделением метилированных сахаров и их количественным определением позволяет оценить число концевых звеньев (содержащих четыре метоксильные группы), число звеньев в неразветвленных участках цепи (содержащих по три метоксильные группы) и число точек ветвления (содержащих по две метоксильные группы). Кроме того, структура метилированных производных дает информацию о расположении связей в сахарных кольцах.
Сравнительно новым методом маркировки редуцирующих концов углеводных цепей является восстановление альдегидных групп бортритидом натрия (NaB3H4). Введенная таким способом радиоактивная метка дает возможность по радиоавтографам хроматограмм определять положение фрагментов, отщепленных от редуцирующих концов.
Одним из наиболее ценных реагентов, используемых для установления структуры углеводов, является йодная кислота (или ее натриевая соль, перйодат натрия). Под действием йодной кислоты расщепляются С—С-связи, по обе стороны от которых расположены ОН-группы, с образованием диальдегидов.
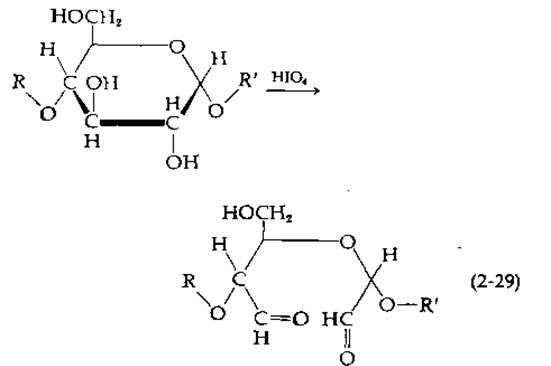
Метод позволяет проводить количественные измерения. Через несколько часов после начала реакции избыток перйодата удаляют этиленгликолем; можно также определить количество перйодата, затраченное в процессе окисления. Если гидроксильные группы связаны с тремя идущими подряд атомами углерода, то центральный атом отщепляется в составе муравьиной кислоты, количество которой тоже можно точно определить. Помимо этого, после удаления избытка перйодата диальдегид можно восстановить добавлением твердого боргидрида натрия с образованием устойчивых СН2ОН-групп и далее с помощью мягкого кислотного гидролиза расщепить ациклические ацетильные связи, разделить полученные фрагменты и провести их модификацию. Эту последовательность реакций называют деградацией по Смиту [144].
При мер комплексного использования нескольких методов для определения структуры сложного полисахарида приведен в табл. 2-12.
Концевые группы полирибонуклеотидов тоже отщепляют перйодатом, предварительно удалив с помощью фосфомоноэстеразы фосфатные группы на З'-гидроксилах. Образующиеся диальдегиды восстанавливают далее бортритидом натрия. Другой метод включения в полинуклеотиды радиоактивной концевой группы основан на переносе фосфорильной группы с молекул АТР под действием неспецифической полинуклеотидкиназы с образованием свободной 5'-гидроксильной группы полирибо- или полидезоксирибонуклеотида [145].
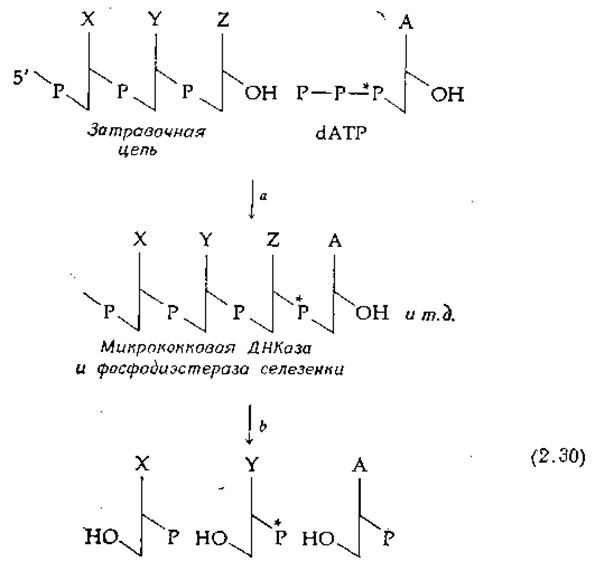
Ценным методом изучения структуры ДНК является метод ближайших соседей. Он разработан А. Корнбергом с сотр. и состоит в следующем [146]. В качестве предшественников для синтеза ДНК берут какой-нибудь один радиоактивный 32Р-содержащий нуклеозидтрифосфат (в уравнении (2-30) это дезоксиаденозинтрифосфат], а три других
Таблица 2-12 Определение структуры содержащего 6-О-метилглюкозу липополисахарида из Mycobacterium phleiа,б
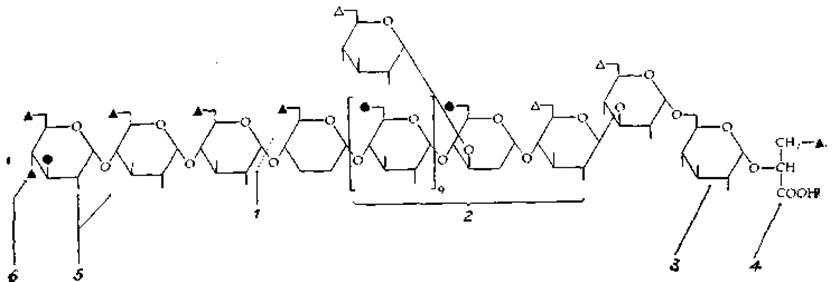
1. Эту связь избирательно расщепляет а-амилаза.
2. В результате частичного гидролиза образуется ряд 6-О-метилглюкозныя олигомеров.
3. Отщепление D-глицериновой кислоты и восстановление образовавшегося конца с помощью NaB3H4 позволяет в ходе последующего расщепления цепи (путем частичного кислотного гидролиза) получить набор' радиоактивных фрагментов.
4. Превращение в сложный эфир и восстановление с помощью NaB3H4 в спирт (глицерин) позволяет после частичного кислотного гидролиза получить другой набор радиоактивных фрагментов.
5. Метилирование устанавливает наличие разветвления, а пропилирование невосстанавливающих концевых группировок — положение глюкозы: и 3-метилглюкозы.
6. По другой методике проводилось замещение О-ацильных групп на —ОСН3. Последующее окисление перйодатом, восстановление с помощью NaB3H4 и гидролиз (деградация по Смиту) приводили к образованию метилированных фрагментов, идентификация которых позволила определить положение исходных ацильных групп.
а Saier М. Н., Jr., Ballou С. Е., J. Biol. Chem., 243, 4332, 1968; Smith W. L., Ballou C. E., J. Biol. Chem., 248, 7118—7125, 1973; Gray G. R., Ballou C. E., J. Biol: Chem., 247, 8129—8135, 1972.
б В положениях, обозначенных зачерненным треугольником, находятся жирные кислоты: 3 ацетила, 1 пропионнл, 1 изобутирил и 1 октаноил; в положениях, обозначенных светлым треугольником, находятся сукцинильные группы. Метильные группы обозначены зачерненным кружком.
нуклеозидтрифосфата оставляют немечеными. В присутствии ДНК-полимеразы, катализирующей рост цепи, цепь затравочной ДНК удлиняется с З'-конца (гл. 15, разд. А.З.а). Присутствующая матричная цепь [в уравнении (2-30) она не представлена] обеспечивает включение в растущую цепь именно того нуклеотида, какой необходим для образования двуспиральной структуры Уотсона — Крика. Химическая сторона этого процесса будет рассматриваться позже (гл. 15, разд. А.З.а) и в данном случае значения не имеет. Важно лишь то, что 32Р попадает в фосфатный мостик, который соединяет нуклеотид, первоначально содержавший 32Р, с 3'-гидроксилом соседнего нуклеотида.
Продукт, содержащий 32Р, далее гидролизуют с помощью микрококковой ДНКазы и фосфодиэстеразы селезенки (табл. 2-11) и получают фрагменты, представленные в уравнении 2:30. Поскольку данные гидролитические ферменты катализируют. L только разрывы b-типа (табл. 2-11), 32Р оказывается теперь в составе нуклеотида, который был ближайшим соседом аденозина в структуре ДНК. Измеряя радиоактивность 3'-нуклеотидов аденина, тимина, цитозина и гуанина, можно узнать частоты встречаемости в ДНК пар АА, ТА, СА и GA. Используя другие радиоактивные нуклеозидтрифосфаты (по одному типу в каждом опыте), получают такие частоты для всех возможных пар. Результаты описанного выше эксперимента показывают, что цепи двойной спирали действительно антипараллельны, как это предсказывали Уотсон и Крик (подробнее об этом см. в книге Дэвидсона [146]), в противном случае частоты ближайших соседей должны были оказаться другими.
Аналогичным образом, но используя расщепление b-типа под действием щелочи, были определены частоты встречаемости различных пар в цепи РНК, синтезированной на ДНК-матрице [145].