Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Как мы изучаем структуру молекул
Определение молекулярного веса
Определение молекулярного веса биополимера зачастую оказывается чрезвычайно важным. Во многих случаях можно рассчитать минимальный молекулярный вес, исходя из содержания наименьшего из компонентов (например, триптофана в белке или железа в гемоглобине). Однако в большинстве случаев молекулярные веса определяют физикохимическими методами [151, 152]. В принципе это довольно просто сделать, измерив осмотическое давление и светорассеяние, однако и эти методы имеют свои трудности. Наиболее надежные результаты дает ультрацентрифугирование. Прямое определение молекулярного веса основано на том, что центрифугирование раствора макромолекул проводят до тех пор, пока не установится седиментационное равновесие [125, 151]. При использовании коротких кювет такое равновесие достигается за несколько часов. Молекулярный вес рассчитывают, измеряя изменение концентрации раствора от центра кюветы к дну.
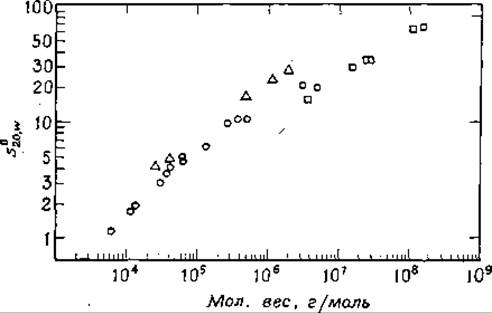
РИС. 2-38. Зависимость константы седиментации ряда белков и нуклеиновых кислот от молекулярного веса (в логарифмическом масштабе). Кружки — глобулярные белки, треугольники — РНК, квадратики — ДНК. В число белков входят липаза (из молока), цитохром с, панкреатическая рибонуклеаза, лизоцим (из белка куриных яиц), фолликулостимулирующий гормон, бактериальные протеазы, гемоглобин человека, бычий протромбин, малатдегидрогеназа, у-глобулин (лошади), триптофаиаза (из Е. coli), глутаматдегидрогеназа (из цыплят) н цитохром а. Двухцепочечная ДНК взята из следующих источников: бактериофага —X174 (репликативная форма), фагов Т7, λb2, Т2 и Т4 и из вируса папилломы. В число РНК вошли тРНК, рРНК н мРНК Е. coli и РНК вируса желтой мозаики репы («CRC Handbook of Biochemistry», Chem. Rubber publ. Co., Cleveland, Ohio, 1968; S. P. Colowick and N. O. Kaplan, eds., «Methods in Enzymology», Vol. 12B, pp. 388—389. Academic Press, New York, 1968).
Чаще всего молекулярный вес биополимеров определяют по их константе седиментации s (разд.З.1.д). Значение s зависит не только от молекулярного веса, но и от плотности и формы молекулы. Однако в рамках предположения, что молекулы белка являются сферами, s примерно пропорционально мол. весу в степени 2/3. Графически зависимость logs от log (мол. вес) должна представляться прямой. На рис. 2-38 приведен график такого рода, построенный по данным для целого ряда белков. Заметим, что точки, полученные для нуклеиновых кислот (во многих случаях эти молекулы имеют форму палочек, а не сфер), ложатся на другую прямую. Кроме того, константа седиментации с увеличением молекулярного веса изменяется быстрее, чем это характерно для сферических молекул.
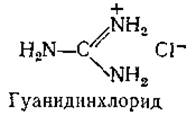
В настоящее время имеется ряд новых методов определения молекулярного веса, которые могут соперничать с ультрадентрифугированием. Один из них — это простая гель-фильтрация. Колонку тщательно заполняют гелем (например, сефадексом) и калибруют, пропуская ряд белковых растворов. Измеряют Vе — объем элюата, собранного с момента нанесения вещества на колонку до момента его выхода из колонки, и делят этот объем на V0 — объем элюата для очень крупных частиц, совершенно не проникающих внутрь частиц геля. Далее строят зависимость Ve/V0 от логарифма мол. веса для ряда белков с известным молекулярным весом. Как и при оценке молекулярных весов по константам седиментации, здесь предполагается, что молекулы всех белков имеют примерно сферическую форму; для неизвестного белка значение молекулярного веса определяют по местоположению отвечающей ему точки на описанном выше графике [153, 154]. Модификацией этого метода служит хроматография при высоких концентрациях гуанидинхлорида — соли, вызывающей денатурацию белков. Предполагается, что в таком растворителе белковая молекула представляет собой статистический клубок [154].
Пожалуй, самым ценным новым методом определения молекулярного веса является гель-электрофорез в присутствии денатурирующего детергента додецилсульфата натрия. Под действием этого соединения белки не только денатурируют, но и покрываются более или менее ровным слоем детергента [155]. Для получающихся в результате палочковидных молекул обычно характерна примерно одинаковая зависимость электрофоретической подвижности от молекулярного веса. Один из примеров такого рода приведен на рис. 2-39, Б. Здесь тоже молекулярный вес исследуемого белка определяется из сравнения скорости его перемещения со скоростями для ряда белков с известным молекулярным весом [153, 156].
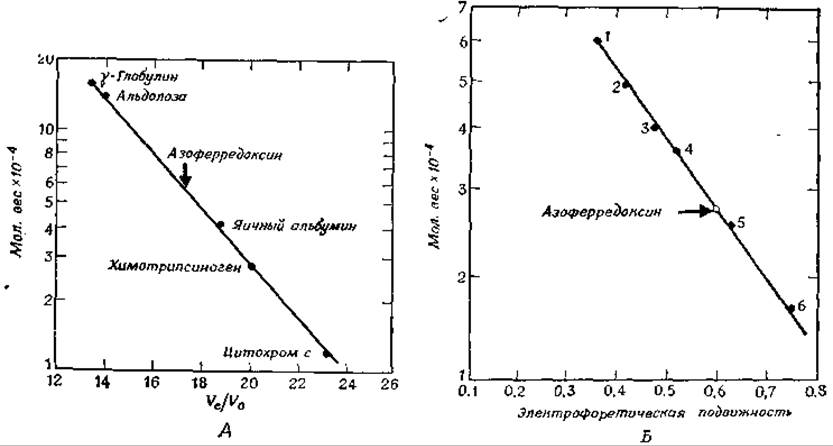
РИС. 2-39. А. Оценка молекулярного веса азоферредоксина в «нативном» состоянии с помощью фильтрации через сефадекс G-200. Черные кружки указывают положение средней точки пика для белков известного молекулярного веса. Стрелкой отмечено положение азоферредоксина. Материал пика для каждого из белков элюирован в 5— 7 пробирок. Скорость элюции составляла 3,2 мл∙час-1. Элюат в коллекторе фракций распределяли по фракциям объемом в 1,6 мл. Б. Оценка молекулярного веса полипептидной цепи азоферредоксина с помощью электрофореза в полиакриламидном геле, содержащем додецилсульфат натрия. Каждая точка получена из четырех стандартных кривых. Маркерными белками служили каталаза (1), фумараза (2), альдолаза (3), глицеральдегидфосфатдегидрогеназа (4), а-химотрипсиноген А (5) и миоглобин (6). Светлый кружок указывает положение азоферредоксина (Nakos G., Mortenson L., Riochemistry 10 457. 1971).