Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Некоторые реакции изомеризации и перегруппировки
Имеется небольшое число метаболических реакций, которые не укладываются ни в один из уже описанных типов реакций и, по-видимому, не связаны с участием кофермента. Эти реакции включают перенос алкильных групп или атомов водорода от одного углерода к другому. Атомы водорода перемещаются в результате прямого переноса без обмена с окружающей средой. Все эти реакции могли бы включать образование карбоний-ионов, однако часто существует несколько возможных механизмов.
Простой 1,3-перенос протона показан в табл. 7-1 как реакция типа 6.А. Примером реакции такого типа является изомеризация олеиновой кислоты в транс-∆10-октадекановую кислоту, катализируемая растворимым ферментом из псевдомонад [172]:

Второй пример — изомеризация изопентенилпирофосфата в диметилаллилпирофосфат [173]:
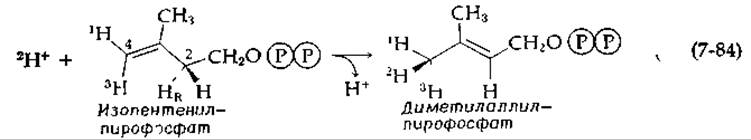
Стереохимическое исследование проводилось с использованием меченного 3Н соединения, показанного в уравнении (7-84). Про-R-протон уходит от С-2, а присоединение протона происходит с rе-стороны к С-4. Когда реакцию проводят в 2H2O, образуется хиральная метильная группа [173], как показано в уравнении (7-84). Предполагаемые механизмы реакции должны учитывать образование карбоний-иона, аниона и процессы присоединения — отщепления. Возможно также согласованное присоединение и отщепление протона, причем такой механизм предполагает транс-стереохимию.
Реакция типа 6.В (табл. 7-1) представляет собой аллильную перегруппировку с одновременной конденсацией с другой молекулой. Эта реакция, приведенная в табл. 7-1, протекает в процессе полимеризации полипренильных соединений (гл. 12, разд. 3). Она могла бы инициироваться образованием карбоний-иона, происходящим в результате отщепления (пирофосфатной группы), или начинаться с образования аниона, происходящего в результате отщепления протона или присоединения нуклеофильной группы фермента. В работе [173а] приведены доводы в пользу механизма с участием карбоний-иона.
Реакция типа 6.В (табл. 7-1) происходит при биосинтезе лейцина и валина (рис. 14-10). Перегруппировку этого типа часто сравнивают с неферментативной, катализируемой кислотами пинакол-пинаколоновой перегруппировкой, в которой имеет место сходный перенос алкильной группы:
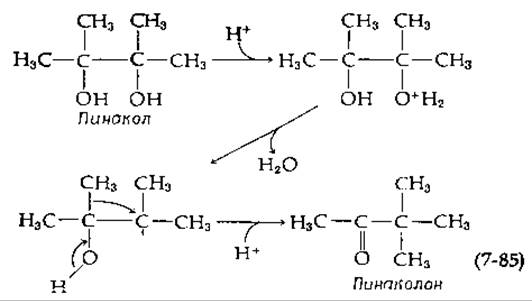
Катализируемая ферментом перегруппировка, по-видимому, приводит к образованию структуры, показанной в табл. 7-1 в скобках, однако тот же самый фермент всегда катализирует восстановление NADP в диол (Mg2+-зависимый фермент, называемый изомероредуктаза ацетооксикислоты). В действительности эта перегруппировка никогда не происходит без соответствующего восстановления [174], и вполне возможно, что существуют механизмы, отличные от того, который приведен в табл. 7-1.
Родственная реакция катализируется глиоксалазой I. — SH-гpyппa трипептида глутатиона (дополнение 7-Ж) присоединяется к альдегидному карбонилу субстрата метилглиоксаля. Продукт подвергается перегруппировке, сопровождающейся перемещением атома водорода (табл. 7-1). Продукт реакции, тиоэфир D-молочной кислоты и глутатиона, гидролизуется вторым ферментом — глиоксалазой II [175,176]. Францен [175] предложил элегантную модель, используя такие соединения, как диметилтиоэтаноламин.
[Примечание, внесенное в корректуре. Последние эксперименты, выполненные с глиоксалазой I с использованием метода ЯМР высокого разрешения, показали, однако, что в том случае, когда реакция протекает в 2Н2О, некоторое количество дейтерия входит в продукт — лактат. При исследовании модельной системы в продукте реакции обнаружен один атом 2Н [176а]. Эти результаты позволяют предположить, что механизм действия глиоксалазы I включает образованием ендиола из аддукта метилглиоксаля и глутатиона. Следовательно, эта реакция должна быть рассмотрена в разделе, посвященном реакциям, катализируемым изомеразами сахаров (разд. И,1).]
Сложная перегруппировка, инициируемая карбоний-ионом, имеет место при введении гидроксильной группы в стерины [реакция 6.Г в табл. 7-І; см. также уравнение (12-31)].
Дополнение 7-Ж
Глутатион — внутриклеточный трипептида,б
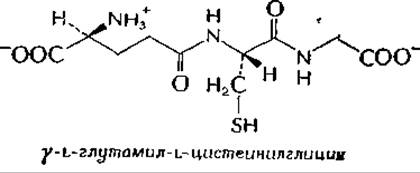
В 1929 г. Ф. Г. Хопкинс открыл трипептид глутатион (GSH) и показал, что он находится в большинстве клеток, если не во всех. В клетках животного происхождения это соединение обычно находится в концентрации ~1—5 мМ. Более низкое содержание обнаружено в бактериях. Глутатион встречается также в зеленых растениях и грибах, но обычным источником его выделения служат дрожжи. Родственный глутатиону пептид с неизвестной функцией, офтальмовая кислота (первоначально выделенная из хрусталика глаза), имеет почти такую же структуру с той лишь разницей, что у офтальмовой кислоты на месте SH-группы находится СН3-группа.
С химической точки зрения особый интерес представляет наличие в глутатионе у-глутамильной связи и свободной —SH-группы. Последняя может окисляться с образованием дисульфидного мостика, связывающего две молекулы глутатиона:
![]()
Именно эти химические свойства и привлекают внимание биохимиков к глутатиону как внутримолекулярному восстанавливающему агенту, основная функция которого состоит в том, чтобы защищать SH-группы белков, сохраняя их в восстановленном состоянии. Глутатион выполняет специфическую роль при восстановлении перекиси водорода (дополнение 10-А) и окисленной формы аскорбиновой кислоты (дополнение 10-Ж).
Глутатион служит коферментом для отдельных ферментов, включая глиоксалазу (разд. Л), малеилацетоацетат-изомеразу [реакция (7-49)] и ДДТ-дехлоргидразу (фермент, катализирующий элиминирование НСl от молекулы инсектицида и проявляющий особо высокую активность в организме мух, устойчивых по отношению к ДДТа). Глутатион является также коферментом при окислении формальдегида в формиат, по-видимому, через промежуточное образование полумеркапталяб,г.
Согласно Майстеру, глутатион играет определенную роль в транспорте аминокислот через мембраны. Детали обсуждаются в гл. 14 (раздел Б, 3) в связи с рассмотрением пути биосинтеза глутатиона.
Считают, что глутатион действует как сигнал к приему пищи у гидры, т. е. выделение глутатиона из поврежденных клеток заставляет гидру заглатывать пищу.
Некоторая специфика в химическом поведении глутатиона связана с перекрыванием величин рКа — SH- и NH+3-групп. Два более высоких значения рКа, соответствующие молекулярным константам диссоциации, составляют 8,74 и 9,62. Были предприняты попытки оценить микроскопические константы (гл. 4, разд. В,3). В одном эксперименте отношение двух форм составляло — 1,8:

Читатель должен суметь, используя это значение и значения макроскопических констант диссоциации, рассчитать микроскопические константы диссоциации Ка, Кb, Кс и Kd.
а Whaley S. G., (1966). Adv. Protein Chem., 21, 1—34.
б Meister A. (1975). Metab. Pathways, 3rd ed, 7, 101—188.
в Gorin G., Esfandi A., Guthrie G. B., Ir. ABB (1975). 168, 450—454.
г Goodman J. І., Tephly T. R. (1971). Biochim. biophys. acta, 252, 489— 505
Вопросы и задачи
1. Гликоген-синтетаза катализирует присоединение глюкозильных звеньев к невосстанавливающим концам цепей гликогена от уридиндифосфатглюкозы согласно уравнению (11-24в). Обсудите возможные механизмы этой реакции. Протекает ли инверсия? Какие эксперименты вы предложите провести для выяснения механизма реакции? [См. Stalmans W., Hers Н. G. (1973). In: The Enzymes, 3rd ed. (P. D. Boyer, ed.), vol. IX, pp. 309—326, Academic Press, New York.]
2. Панкреатическая липаза катализирует гидролиз триглицеридов до диглицеридов и моноглицеридов в кишечном тракте. Диэтил-n-нитрофенилфосфат инактивирует фермент с выделением стехиометрического количества n-нитрофенола. Фосфат оказывается присоединенным к остатку серина в последовательности Leu-Ser-Gly-His. Фермент инактивируется при фотоокислении, а график зависимости от pH свидетельствует об участии в ферментативном катализе группы с рКа = 5,8 [Desnuelle Р. (1972). In: The Enzymes, 3rd ed. (P. D. Boyer, ed.), vol. VII, pp. 575—616, Academic Press, New York].
Предложите приемлемый механизм действия этого фермента.
3. Проведите различие между: а) гидролазами и гидратазами, б) фосфатазами и фосфорилазами, в) экзопептидазами и эндопептидазами, г) пепсином и катепсином, д) трипсином и химотрипсином, а) трипсином и трипсиногеном.
4. Сравните свойства и механизм действия трипсина, пепсина и карбоксипептидазы; карбоксипептидазы и карбоангидразы; фруктозодифосфат-альдолазы и ацетоацетатдекарбоксилазы.
5. Одной из стадий биосинтеза пуринов является следующая реакция, катализируемая единым ферментом, глицинамидриботид-синтетазой (рис. 14-31, реакция б):
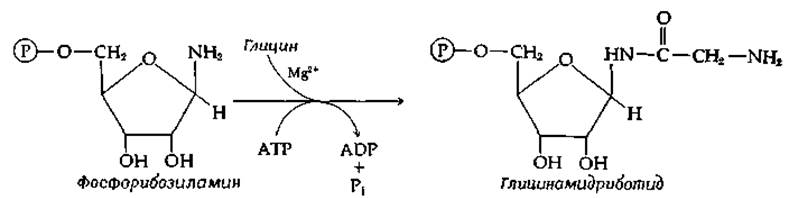
Эта реакция обратима; когда реакция протекает в обратном направлении, фосфат может быть заменен арсенатом (но синтеза АТР при этом не происходит). При добавлении 18O-содержащего ортофосфата один атом 18O из этого фосфата был обнаружен в глицине, образующемся в обратной реакции.
Предложите подходящий механизм.
6. Для фермента этанолкиназы из псевдомонад получены следующие результаты.
Графики зависимости обратной величины начальной скорости от обратной величины концентрации этанола при различных заданных концентрациях АТР представляют собой семейство кривых, пересекающихся в одной точке. Такой же вид имеют графики зависимости обратных величин скорости от обратной концентрации АТР при различных заданных уровнях этанола. Обменная реакция ATP⇄ADP протекает с заметной скоростью, однако другая обменная реакция Этанол⇄Этанолфосфат в присутствии данной киназы не протекает. Если фермент предварительно инкубировали с у-32Р-АТР и затем пропускали через сефадекс, то оказывалось, что он содержит 32Р.
Переноса 32Р от обработанного подобным образом фермента на этанол не наблюдалось, но происходило медленное освобождение 32Р-фосфата в раствор.
а. Предложите механизм действия этого фермента.
б. Объясните описанные экспериментальные наблюдения, используя предложенный вами механизм действия фермента.
7. 2-кето-3-дезокси-L-арабонат — дегидратаза из Pseudomonas saccharophila катализирует следующую реакцию:
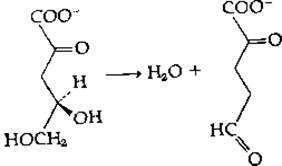
Восстановление боргидридом натрия в присутствии субстрата приводит к фиксации последнего на ферменте.
Предложите приемлемый механизм.