Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Коферментные формы витамина В12
Синтез метана
Второй тип переноса метильной группы от метилкобаламина имеет место при образовании метана анаэробными бактериями, количественно важной реакцией в биосфере. Метаногенные бактерии могут превращать метильные группы метанола, ацетата или N5-CH3-H4Fol в метан, а также восстанавливать СО2, формальдегид или формиат в метан.
Заслуживает внимания тот факт, что в роли кофактора выступает не витамин В12 как таковой, а фактор А — корриноил, содержащий 5-оксибензимидазол (стр. 286). Реакции, ведущие к синтезу метилкорриноида, не известны, но если добавить витамин B12s (Со+), то метальные группы могут быть связаны в виде метилкобаламина, что указывает на наличие Со+ в природном корриноидном носителе. Некоторое время полагали, что метилкорриноид непосредственно восстанавливается водородом до метана, но недавно было показано, что для этого необходим низкомолекулярный кофермент, названный коферментом М [187]. Этим коферментом является простая сульфоновая кислота, структура которой показана ниже [уравнение (8-87)].

Тиоловые группы восстановленного кофермента реагируют с метил-корриноидом с образованием метилированного кофермента М, при восстановлении которого водородом, требующем участия АТР и Mg2+, высвобождается метан [188]. Природным восстановителем может быть либо Н2 в сочетании с гидрогеназой (гл. 10, разд. Е,1), либо пируват при посредстве восстановленного ферредоксина, образующегося под действием пируват : ферредоксин — оксидоредуктазы (разд. К,3).
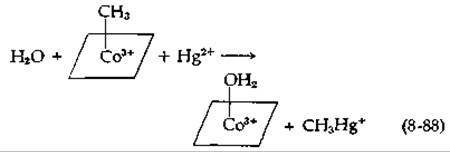
Третьей важной реакцией переноса метальных групп является перенос от метилкорриноидов на ртуть, мышьяк, селен или теллур. Эти реакции представляют особый интерес, поскольку приводят к образованию метил- и диметилртути и диметиларсина — соединений, обладающих токсическим действием [189]. Ранее мы рассмотрели реакции переноса, в которых метильная группа переносится от метилкорриноида на нуклеофильные группы, например на —SH-группу гомоцистеина. В этих реакциях метильная группа в действительности переносится в виде положительного СН3-иона, т. е. в результате нуклеофильного замещения при атоме углерода (как и в случае переноса метильной группы от S-аденозилметионина или метил-Н4Роl). Напротив, перенос на Hg2+ осуществляется в виде карбаниона СН-3 без изменения валентности кобальта. Метилкорриноиды в отличие от других трансметилирующих агентов (таких, как S-аденозилметионин) способны вступать в реакции этого рода без участия ферментов. Отметим, что после протекания реакции (8-88) кобальт находится в состоянии 3+. Реметилирование корриноида возможно, по-видимому, лишь после восстановления кобальта до Со(II). [Вторая метильная группа может переноситься в результате реакции того же типа с образованием (CH3)2Hg.]
Реакция метилирования мышьяка имеет важное значение в связи с проблемой загрязнения окружающей среды, что объясняется широким использованием соединений мышьяка в качестве инсектицидов и присутствием арсената в фосфате, используемом в бытовых моющих средствах [189, 190]. После восстановления в арсенит метилирование протекает в две стадии [уравнение (8-89)].
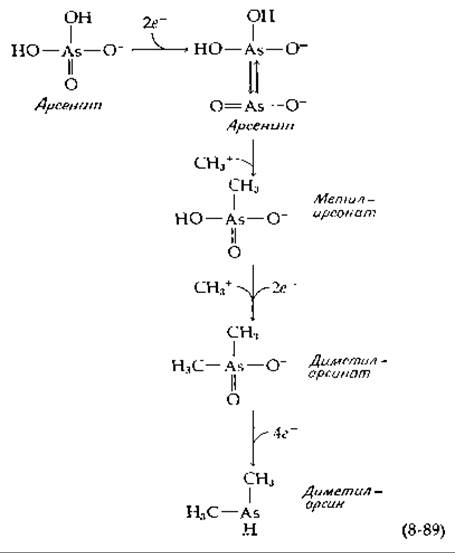
Дополнительные стадии восстановления приводят к образованию диметиларсина, одного из основных продуктов действия метаногенных бактерий на арсенат. Хотя и существует предположение, что перенос метила протекает через образование СН3 с одновременным отрывом протона от субстрата, детали этой реакции пока еще изучаются. Радикал СН3 может переноситься с образованием кобальт(ІІ)-корриноида [191].
Анаэробные бактерии Clostridium aceticum могут получать энергию для роста в результате восстановления СО2 водородом [163, 191]:
![]()
Вероятно, одна из молекул СО2 восстанавливается до формиата, а затем до метилкорриноида. Последний в результате какого-то пока еще не установленного процесса соединяется с другой молекулой СО2 с образованием ацетата. Предполагается существование карбоксиметилкобальтового промежуточного соединения

Существуют данные, свидетельствующие о том, что СО2 не включается непосредственно, а переносится от пирувата [192].
Как мы видели, витамин B12 и его аналоги являются катализаторами с многообразными функциями. Сколько реакций, зависящих от них, еще не открыто? Как происходит катализ соответствующих реакций в зеленых растениях и других организмах, не располагающих кобальтсодержащими катализаторами? Ответы на эти вопросы могут принести много неожиданного.
Вопросы и задачи
1. Следующие заболевания обусловлены недостаточностью отдельных витаминов. С каким витамином вы связываете каждое из перечисленных заболеваний: а) цингу, б) рахит, в) бери-бери, г) пеллагру?
2. Заполните следующую таблицу:
|
Тип реакции или фермент |
Кофермент или простетическая группа |
|
Декарбоксилированне аминокислот Декарбокснлирование а-кетокислот Окислительное декарбоксилирование а-кетокислот Транскетолаза Пируваткарбоксилаза ß-Кетотиолаза Трансаминирование Перенос формильной группы Образование метана |
3. В состав каких коферментов входит ADP?
4. Рассмотрите расщепление связей углерод—углерод в метаболических циклах и укажите отдельные ферментативные реакции. Резюмируйте, каковы общие, на ваш взгляд, закономерности реакций этого типа.
5. Назовите субстрат, типичный для пиридоксальфосфатзависимых ферментов. Изобразите формулу кофермент-субстратного промежуточного соединения. Поясните механизмы трансаминирования, декарбоксилирования и дезаминирования (ß-оксиаминокислот) как реакции, катализируемые ферментами этой группы.
6. Что представляет собой тиаминдифосфат (тиаминпирофосфаг)? Каким образом он реагирует с а-кетокислотными субстратами? Представьте подробно механизмы декарбоксилирования а-кетокислот а) до альдегидов и б) до производных ацилкофермента А. в) Обрисуйте в общих чертах механизм действия фермента транскетолазы.
7. Напишите формулу липоевой кислоты и поясните связывание этого соединения с белками. Покажите точно, каким образом это соединение участвует в окислительном декарбоксилировании а-кетокислот.
8. Какова формула биотина и как он связан с ферментами. Напишите уравнения двух стадий каталитического механизма биотиновых ферментов.
9. Проиллюстрируйте превращение фолиевой кислоты в тетрагидрофолиевую кислоту. Напишите уравнения реакций последней а) с формальдегидом, б) с муравьиной кислотой и в) с серином. Укажите, как переносится одноуглеродный фрагмент на г) пурины, д) метионин и е) метильную группу тимина.
10. Приведите примеры типичных окислительных превращений NAD+ и NАDP+. Укажите основной источник NADH в клетках. Сравните соотношения [NADH+]/[NAD+] и [NADPH]/[NADP+] в тканях. Какова обычная судьба HADH в метаболизме?
11. Перечислите некоторые типичные субстраты флавинопротеидов. Проиллюстрируйте обратимое восстановление простетической группы. Напишите химические реакции, протекающие с участием флавопротеидов а) в окислении жирных кислот, б) в цикле трикарбоновых кислот и в) в цепи переноса электронов.
12. Напишите уравнение той реакции в метаболизме пропионовой кислоты, которая зависит от коферментной формы витамина В12.
13. Тимидин-5'-фосфат (тимидиловая кислота, dTMP) образуется в результате превращений дезоксиуридин-5'-фосфата (dUMP), включающих перенос одноуглеродного фрагмента от тетрагидрофолиевой кислоты.
а. Изобразите формулу дезоксиуридин-5'-фосфата и метилентетрагидрофолиевой кислоты. Предложите постадийный механизм реакции этих двух соединений с образованием dTMP.
б. Т-четный бактериофаг содержит 5-оксиметилцитидиловую кислоту. Предложите механизм синтеза этого нуклеотида.
Примечание. Эти реакции рассмотрены в гл. 14.