Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Коферментные формы витамина В12
Реакции переноса метильных групп
Образование и использование метильных групп — количественно существенный аспект метаболизма всех клеток. Как показано выше (разд. Л,3), метальные группы могут возникать при восстановлении одноуглеродных соединений, прикрепленных к тетрагидрофолиевой кислоте. Метильные группы метилтетрагидрофолиевой кислоты (N5—СН3-— H4Fol) могут затем переноситься на атом серы гомоцистеина с образованием метионина:
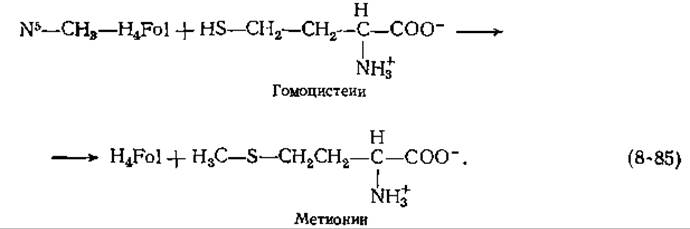
Последний превращается в S-аденозилметионин (SAM), практически универсальный донор метильных групп в реакциях трансметилирования [реакция (7-1)]. У некоторых бактерий, грибов и высших растений метил-Н4Fоl: гомоцистеин—трансметилаза не нуждается в витамине. В12. Однако организм человека, так же как и различные штаммы Е. coli и некоторые другие бактерии, нуждается в метилкобаламинозависимом ферменте. Он, вероятно, функционирует в циклическом процессе. Предполагают, что кобальт представлен двумя взаимопревращающимися окислительными состояниями (1+ и 3+) [уравнение (8-86)].
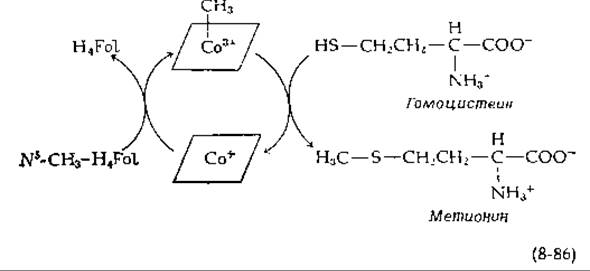
Первым указанием на это послужили исследования Вайсбаха, который показал, что 14С-меченый метилкобаламин может быть выделен в результате обработки фермента метальными донорами, такими, как S-аденозилметионин и метилиодид, после восстановления (например, восстановленным рибофлавинфосфатом). Эта обработка соответствует схеме лабораторного синтеза метилкобаламина [реакция (8-73)]. Тем не менее механизм действия трансметилазы весьма сложен. Вначале фермент должен «активироваться» S-аденозилметионином или метил-иодидом, затем он совершает циклы согласно схеме (8-86), но постепенно инактивируется. Предполагают существование еще одной формы фермента, которая активируется путем метилирования S-аденозилметионином [186].