Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Белки с негемовым железом
Далеко не все железо внутри клеток образует хелатные комплексы с порфириновыми группами. Хотя гемэритрин был известен на протяжении многих лет (разд. Б,4), важное значение белков, содержащих негемовое железо, стало ясным лишь после того, как Крэйн в 1945 г. разработал метод получения больших количеств митохондрий. Было отмечено, что содержание железа в митохондриях намного превосходит его содержание в гемопротеидах. Важное открытие сделал в 1960 г. Г. Бейнерт, изучавший митохондриальные дегидрогеназные системы, специфичные к сукцинату и к NADH. Он заметил, что в тех случаях, когда цепь переноса электронов была частично восстановлена этими субстратами, растворы, замороженные при низкой температуре, давали сильный сигнал ЭПР со значением g = 1,94. Сигнал возникал лишь после восстановления субстратами, а результаты фракционирования свидетельствовали, что его дают белки с негемовым железом. Хотя функция этих белков до сих пор не вполне выяснена, было высказано предположение, что по крайней мере шесть белков этого типа присутствуют в цепи переноса электронов [35, 36а]. Еще три таких белка ассоциированы с флавинсодержащей сукцинатдегидрогеназой (гл. 8, разд. И,3) [36b].
Еще более очевидно присутствие белков с негемовым железом у клостридий, которые вообще не содержат гема. Именно из этих бактерий был выделен первый негемовый железосодержащий белок, названный ферредоксином. Этот белок, обладающий поразительно низким восстановительным потенциалом (Е0 = —0,41 В), участвует в реакции, катализируемой пируват: ферредоксин—оксидоредуктазой (гл. 8, разд. К,3), в фиксации азота у некоторых видов и в образовании Н2. Он представляет собой небольшой белок зеленовато-коричневого цвета, содержащий всего 54 аминокислотных остатка, но образующий комплекс с восемью атомами железа. Если снизить pH до ~1, освобождается восемь молекул H2S. Таким образом, белок содержит восемь атомов «лабильной серы», каким-то образом связанных железо-сульфидными связями. Ферредоксины оказались только первыми представителями большого семейства открытых позднее железо-серных белков [37—39]. Большинство из них содержит железо и «лабильную серу» в отношении 1:1, но число атомов железа на молекулу белка оказывается различным. Кроме того, одна группа белков вообще не содержит «лабильной серы»: железо в них удерживается боковыми цепями четырех остатков цистеина. Наиболее простые железо-серные белки могут быть разбиты на классы в соответствии с приводимой ниже таблицей. Помимо них, имеются более сложные железо-серные белки, такие, как нитрогеназа (гл. 14, разд. А,2), которые содержат также молибден. Стандартные восстановительные потенциалы железо-серных белков покрывают поразительно широкий интервал значений от —0,42 В для ферредоксина шпината до +0,35 В для так называемого железо-серного белка с высоким потенциалом из Chromatium.
|
Содержание железа и лабильной серы |
Наименование белка |
|
1 Fe |
Рубредоксин |
|
2 Fe, 2 S2- |
Ферредоксин из хлоропластов, адреноредоксин, путидаредоксин, ферредоксин Е. coli [40] |
|
4 Fe, 4 S2- |
Железосодержащий белок с высоким потенциалом (Chromatium), некоторые бактериальные ферредоксины, гидрогеназа |
|
Fe, nS2- |
Бактериальные ферредоксины (обычно n=8) |
Структура нескольких таких белков определена методами рентгеновской кристаллографии [38, 41]. Простейший из них — рубредоксин из Clostridium pasteurianum, небольшой пептид с мол. весом ~6000 (рис. 10-4). Среди его 54 аминокислотных остатков имеются четыре остатка цистеина, боковые цепи которых образуют искаженный тетраэдр вокруг единственного атома железа [38]. Три Fe—S-связи имеют «нормальную» длину — около 0,23 нм, но четвертая, с остатком цистеина-41, оказалась необычно короткой (0,205 нм). Функция клостридиального рубредоксина точно не известна; считается, что он участвует в переносе электронов и может заменять в некоторых реакциях ферредоксин. Имеется и более крупный рубредоксин с мол. весом ~ 19 000, который связывает два иона железа; он участвует в переносе электронов, входя в состав гидроксилазной системы клеток Pseudomonas (разд. Ж,2, е) [42].

РИС. 10-4. Модель пространственной укладки пептидной цепи и координация железа в рубредоксиие из Clostridium pasteurianum. А и В — N- и С-концы. Из работы Неriott 5. R., Sieker L. С.. Jensen L. H., Lovenberg W., JMB, 50, 391—406 (1970).
Рентгеноструктурные исследования показали, что в железосодержащем белке с высоким потенциалом из Chromatium полипептидная цепь из 86 аминокислотных остатков обернута вокруг железо-серного кластера, содержащего боковые цепи четырех остатков цистеина и еще по четыре атома железа и по четыре атома серы (рис. 10-5) [41]. Каждый из четырех атомов серы в остатках цистеина связан с одним атомом Fe, и эти четыре атома Fe образуют нерегулярный тетраэдр с расстоянием Fe—Fe 0,28 нм. Четыре атома лабильной серы (S2-) образуют тетраэдр со стороной 0,35 нм, в котором каждый из атомов серы связан с тремя атомами железа. Обычно кластер может принять только один электрон. Структура такого железо-серного кластера явилась в какой-то мере неожиданной, но вслед за ее открытием было установлено, что ионы типа [Fe4S4(S—СН2СН2СОО-)4]6- самопроизвольно образуются из своих компонентов и имеют сходную кластерную структуру [43, 44]. Таким образом, живые организмы, как обычно, только усовершенствовали структуру, возникшую в неживой природе.
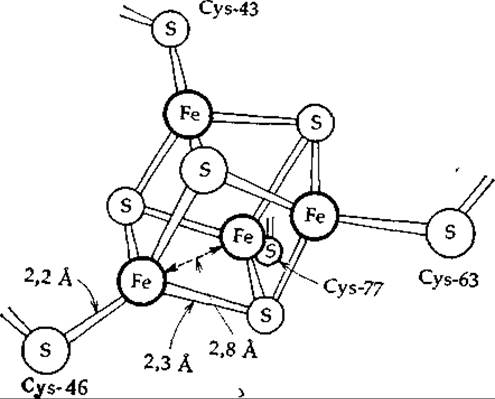
РИС. 10-5. Fe4S4-кластep в железосодержащем белке с высоким потенциалом из Chromatium.
На рис. 10-6 изображена структура бактериального ферредоксина из Peptococcus aerogenes [38, 45]. Обратите внимание, что этот белок с восемью атомами Fe и восемью атомами лабильной серы содержит два кластера Fe4S4с практически такой же структурой, что и в белке из Chromatium. Каждый кластер, по всей видимости, принимает один электрон. Аминокислотная последовательность первой половины цепи во многом повторяется во второй половине, в связи с чем напрашивается предположение, что эта половина цепи возникла в результате удвоения гена. В последовательности имеется много инвариантных мест, включая положения остатков цистеина, образующих Fe—S-кластер.
Удивительно то, что восстановительные потенциалы бактериальных ферредоксинов (Fd) и белка с высоким потенциалом из Chromatium при всем сходстве в структуре их активных центров очень сильно различаются. Полагают, что кластеры Fe4S4могут находиться в трех состояниях окисления [уравнение (10-8)], последовательно отличающихся одно от другого одним электроном [46—49].
Белок из Chromatium и ферредоксины, вероятно, имеют сходное среднее состояние окисления1).

РИС. 10-6. Модель пространственного расположения атомов а-углерода, железа и серы в ферредокснне из Peptococcus aerogenes [45]. Кружки с точкой в середине — Fe, светлые кружки — S2+, кружки с пересекающимися линиями — S (цистеин) и темные кружки — Са
В более окисленных состояниях размер кластера немного меньше (в белке из Chromatium расстояние Fe—Fe при окислении меняется с 0,281 до 0,272 нм). Синтетические железо-серные кластеры имеют слабоосновные свойства [47] и являются акцепторами протонов, имеющих значения рКа от 3,9 до 7,4.

1) Однако в ферредокснне из Azolobacter, содержащем 8 атомов железа, один кластер имеет Е0 =—0,42 В, а другой Е0 = +0,34 В; из спектров ЭПР следует, что оба кластера, несмотря на сильные различия в их потенциалах, совершают переход между состояниями окислення —2 и —1 (окисленное н суперокисленное состояние; рис. 10-8 [49а]). Растворимая сукцииатдегидрогеназа млекопитающих содержит три железо-серных кластера со значениями Е0 —0,40 В, —0,005 В и +0,06 В. В этом ферменте центр с самым высоким потенциалом, по-видимому, также совершает переход, между состояниями -2 и -1 [уравнение (10-8)] [49b].
Из некоторых железо-серных белков можно удалить железо и лабильную серу, а затем снова реконструировать активный фермент, соответствующим образом добавляя сульфид и атомы железа. Аналогичным образом можно произвести обмен природного изотопа 56Fe (с нулевым ядерным спином) на изотоп 57Fe, имеющий магнитные ядра [50]. Точно так же 32S можно заменить на 77Se. Образующиеся белки функционируют без видимых нарушений и дают на спектрах ЭПР сверхтонную структуру, возникающую вследствие взаимодействия ядер с неспаренными электронами кластеров (рис. 10-7). Эти наблюдения позволяют заключить, что электроны, принимаемые Fe4S4-кластерами, не локализованы на атомах какого-то одного типа, а взаимодействуют и с ядрами Fe, и с ядрами S.
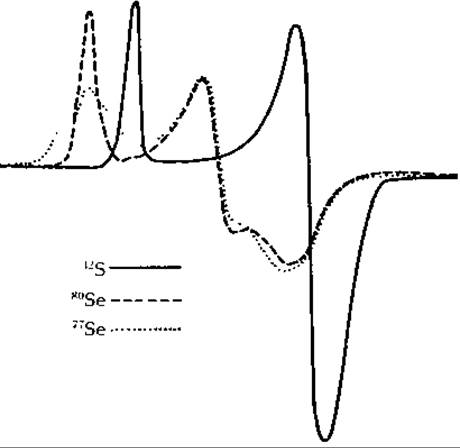
РИС 10-7. Спектр электронного парамагнитного резонанса Fe-S-белка путидаредоксина в естественной форме (32S) и с заменой лабильной серы на изотопы селена. В слабопольном конце спектра для 77Sе-содержащего белка ![]() видны хорошо выраженные плечи пика. Из работы Orme-Johnson W. Н., Hansen R. Е., Beinert H.fc Tsibris J. С. M., Bartholomaus R. C., Gunsalus I. C., PNAS, 60, 369—372 (1968).
видны хорошо выраженные плечи пика. Из работы Orme-Johnson W. Н., Hansen R. Е., Beinert H.fc Tsibris J. С. M., Bartholomaus R. C., Gunsalus I. C., PNAS, 60, 369—372 (1968).
Ферредоксины хлоропластов содержат два атома железа и два атома лабильной серы; их вероятная структура имеет следующий вид:

Хотя трехмерная структура ферредоксина хлоропластов не установлена, определена структура ряда родственных модельные соединений [51].