Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Хиноны как переносчики водорода
В 1955 г. Мортон и его сотрудники в Ливерпуле сообщили о выделении широко распространенного хинона неизвестной структуры [52]. Названный убихиноном из-за его повсеместного присутствия (в переводе это означает «вездесущий хинон»), он был в 1958 г. охарактеризован как бензохинон, присоединенный к ненасыщенной изопреноидной боковой цепи (рис. 10-8). В действительности имеется семейство убихинонов: типичные убихиноны из бактерий содержат шесть изопреноидных звеньев в боковой цепи, тогда как в убихиноне из митохондрий млекопитающих насчитывается 10 таких звеньев. Убихинон независимо выделили Крэйн и сотрудники, использовавшие изооктан для экстракции митохондрий. Эти исследователи предположили, что выделенный ими новый хинон, который они назвали кофермент Q, может функционировать в цепи переноса электронов. Название убихинон и сокращение Q теперь стали общепринятыми. Нижний индекс указывает число изопреноидных звеньев, например Q10. Убихинон может быть обратимо восстановлен в гидрохинон (рис. 10-8), что служит предпосылкой его участия ß системе переноса электронов [62—56].
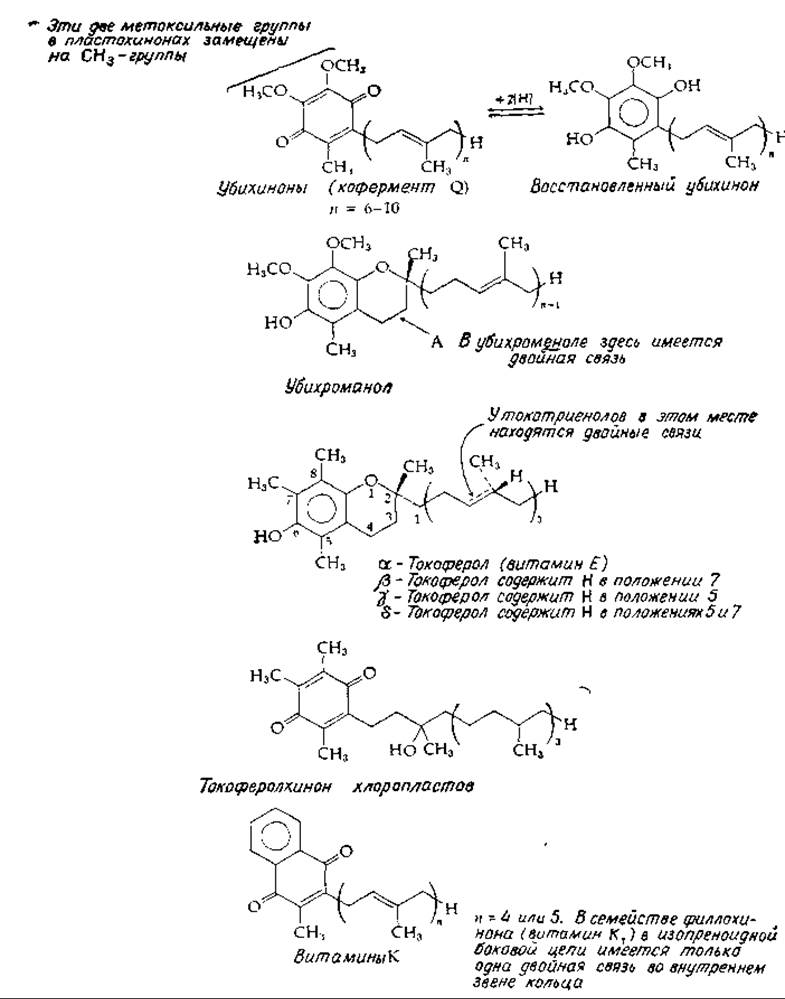
РИС. 10-8. Структура изопренондных хинонов и витамина Е.
Близкородственная группа пластохинонов имеется в хлоропластах (гл. 13, разд. Д,6). В этих соединениях две метоксильные группы убихинона замещены на метальные группы. Наиболее широко представлен пластохинон А, насчитывающий девять изопреноидных звеньев [56].
Присоединение гидроксильной группы восстановленного убихинона или пластохинона к близко расположенной двойной связи приводит к образованию структуры хроман-6-ола. Соединения, образующиеся таким путем из убихинона, называются убихроманолами (рис. 10-8). Из почек человека был выделен убихроменол (рис. 10-8). Из пластохинона образуются пластохроманолы. Пластохроманол, соответствующий пластохинону А, был впервые выделен из табака и известен также под названием соланохромена. Близкородственным и важным семейством хроманолов являются токоферолы, различные формы витамина Е (рис. 10-8). Токоферолы синтезируются растениями и находятся преимущественно в растительном масле; они являются обязательным компонентом пищи для человека и других животных. Наиболее важной формой витамина Е является а-токоферол; в меньших количествах присутствуют также ß-, у- и δ-формы. Кроме того, имеется группа токотриенолов, содержащих ненасыщенные изопреноидные звенья. а-Токоферол имеет конфигурацию 2R, 4'R, 8'R, как указано на рис. 10-8. При окислении а-токоферола, например, хлорным железом кольцо может раскрыться в результате гидролиза с образованием токоферолхинонов (рис, 10-8), которые в свою очередь могут быть восстановлены в токоферолгидрохиноны. Большие количества токоферолхинонов имеются в хлоропластах.
Другим важным семейством хинонов, очень сходных по структуре с уже обсуждавшимися хинонами, является семейство витаминов К (рис. 10-8). В природе они подразделяются на два семейства. Витамины K1 (филлохиноны) имеют только одну двойную связь в боковой цепи, находящуюся в изопреноидном звене, ближайшем к кольцу. Это открывает возможность образования хроманолов. В семействе витамина К2 (менахиноны) двойные связи имеются во всех изопреноидных звеньях. Синтетическое соединение менадион полностью лишено изопреноидной боковой цепи, а в соответствующем месте кольца стоит водород. Тем не менее менадион используется как синтетической витамин К и, по-видимому, может быть уже в организме переведен в формы, имеющие изопреноидные боковые цепи.
Каковы же функции этих интересных хинонов и хроманолов? По имеющимся на сегодня представлениям, убихиноны являются компонентами цепи переноса электронов, растворимыми в липидах митохондриальных мембран. Подразумевается, что пластохиноны выполняют аналогичную функцию в системах переноса электронов, находящихся в мембранах хлоропластов. С другой стороны, функции витаминов Е и К пока определенно не известны. Имеются данные, что в некоторых микобактериях витамин К входит в цепь переноса электронов и функционирует точно так же, как убихиноны у млекопитающих. Некоторые бактерии содержат как менахиноны, так и убихиноны. Однако у высших организмов единственная известная в настоящее время функция витамина К связана с синтезом белков, необходимых для свертывания крови (дополнение 10-Г).
Наиболее широко признанной функцией легко окисляемых токоферолов является антиоксидантная функция — освобождение клеток от появляющихся в них свободных радикалов (дополнение 10-В). При удалении одного атома водорода из гидрохинона или хроманола, такого как токоферол, образуется свободный радикал [уравнение (10-9)1. Особенно устойчивые радикалы дают фенолы, замещенные во 2-м, 4-м или 6-м положениях. Способность к образованию относительно устойчивых свободных радикалов токоферола можно объяснить как наличием метильных заместителей, так и образованием хроманольной структуры.

Пока не совсем ясно, насколько важна способность к образованию устойчивых радикалов для функционирования убихинонов и пластохинонов. Еще одни вопрос относится сразу ко всем этим соединениям: зачем нужна длинная изопреноидная боковая цепь? Простой ответ состоит в том, что она служит якорной цепью, удерживающей соединение в липидной части клеточных мембран, где эти соединения функционируют. Относительно убихинонов обычно именно так себе и представляют, что хинон свободно перемещается в липидной фазе как в окисленном, так и в восстановленном состоянии, осуществляя транспортировку электронов от одного переносчика к другому.
Можно ли рассматривать убихинон как новый витамин? Имеющиеся на сегодня данные говорят, что нельзя и что животные способны синтезировать это соединение в достаточных количествах [52]. Однако появились сообщения, что убихиноны оказывают благоприятный эффект у больных с мышечной дистрофией. Сообщалось также о пониженном содержании убихинона в деснах при воспалении надкостницы [57].
Дополнение 10-В
Семейство витамина Е: токоферолы
Витамин Е стал известен в 1926 г. как фактор, предотвращающий стерильность крыс, питавшихся прогорклыми липидамиа. Лечебным фактором, присутствующим в высоких концентрациях в семенах пшеницы и в масле семян салата, оказались соединения, составляющие семейство витамина Е, токоферолы (рис. 10-8). Первый из них выделили в 1936 г. Эванс и сотрудники.
Недостаточность витамина Е вызывает у кроликов и крыс дистрофию мышечной ткани (алиментарную мышечную дистрофию; см. также дополнение 9-Е). Наблюдалось также множество других симптомов, различных для разных видов. У животных с недостаточностью витамина Е наблюдалось выраженное истощение, которое нередко приводило к внезапной смерти. Мышцы больных крыс характеризуются чрезмерно высокой скоростью потребления кислорода, а при электронно-микроскопическом исследовании обнаруживаются аномалии в мембранах эндоплазматического ретикулума. Существует предположение, что непосредственной причиной смерти при Е-авитаминозе служит разрушение лизосомных мембран.
Потребность в токоферолах для человека точно не установлена; вероятная норма составляет около 5 мг/день и еще 0,6 мг на каждый грамм потребляемых полиненасыщениых жирных кислот. Подсчитано, что поступление токоферолов в организм человека составляет около 14 мг/день, однако все возрастающее употребление высокорафинированной пищи может снизить потребление токоферолов до опасно низкого уровня. Самыми богатыми источниками токоферолов служат растительные масла, в продуктах животного происхождения они содержатся в меньших количествах.
В вопросе о функции токоферолов еще много неясногоа-в. По общепринятым представлениям, их главная функция состоит в том, что они служат антиоксидантами по отношению к ненасыщенным липидам. В этой роли токоферолы могут защищать липидные мембраны от действия свободных радикаловг. Радикалы, образующиеся под действием ферментов или в неферментативных реакциях, катализируемых следовыми количествами переходных металлов, могут инициировать аутокаталитическую цепную реакцию следующего типад
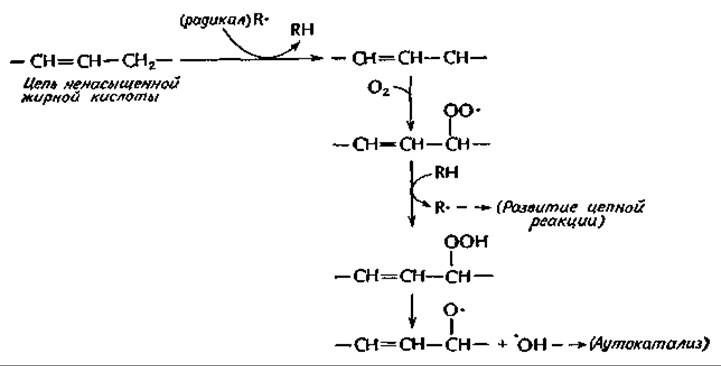
Изображенная здесь последовательность реакций включает регенерирование радикала R∙, обеспечивающего развитие цепной реакции, и одновременное образование органической перекиси, которая может распадаться на два радикала, вступающие в последующие реакции. Таким образом, развиваемся аутокаталитический процесс, приводящий к быстрому прогорканию жиров. Процесс сопровождается различными разрывами цепи и реакциями димеризации.
Присутствие небольших количеств токоферола ингибирует эти процессы перекисного окисления жиров; по всей вероятности, радикалы захватываются токоферолами, с которыми они образуют более устойчивые радикалы токоферола [уравнение (10-9)]е, способные димеризоваться или вступать в реакцию с другими радикалами, прерывая таким образом дальнейшую цепь реакций. В пользу именно такой функции витамина Е свидетельствует тот факт, что у некоторых видов животных токоферол удавалось заменить N,N'-дифенил-n-фенилендиамином, синтетическим антиоксидантом (структура близкородственного соединения приведена в табл. 10-3).
Одним из неблагоприятных последствий перекисного окисления липидов считается образование малонового альдегида в результате обусловленного радикалами разрыва полиеновых кислотж. Этот бифункциональный альдегид образует шиффовы основания с аминогруппами белка, выступая в качестве сшивающего агента. В результате сшивки образуются нерастворимые липид-белковые комплексы, называемые пигментами изнашивания (или липофусцинами)з.
![]()
Три поколения крыс получали корм, лишенный токоферола, но содержавший при этом N,N'-дифенил-n-фенилендиамин; оказалось, что присутствие N,N'-дифенил-n-фенилендиамина устраняет далеко не все болезненные симптомы. Следовательно, вполне возможно, что токоферолы играют и более специфическую роль, вероятно, на уровне клеточных мембран. Сводится ли она к защите каких-то компонентов системы переноса электронов или они связаны с непосредственным участием в окислительно-восстановительных процессах, пока что неизвестно.
а Sebrell W. Н, Jr, Harris R. S, eds., The Vitamins, Vol. 5, Academic Press, New York, 1972.
б Wasserman R. H., Taylor A. N, Annu Rev. Biochem., 41, 179—202 (1972).
в DeLuca H. F., Suttie J. W., eds, The Fat-Sotuble Vitamins, Univ. of Wisconsin Press, Madison, Wisconsin, 1970
г Molenaar I., Kos J., Hommes F. A., Vitam. Horm. (N. Y.), 30, 45—82 (1972).
д Artman N. R, Adv. Lipid Res., 7, 245—330 (1969).
e Nilsson J. L. G., Daves G. D., Jr., Folkers K., Acta Chem Scand., 22, 207—218 (1968).
ж Chio K. S., Tappet A. L, Biochemistry, 8, 2827—2832 (1969).
з Было зарегистрировано несколько форм уроидного липофусциноза — болезни, связанной с накоплением липофусцина в нейронах, приводящим к прогрессирующей дегенерации ткани мозга В лейкоцитах больных не было обнаружено пероксидазы [D. Armstrong, S. Dimmitt, D Н. Boehme, S. C. Leonberg, Jr, and W. Vogel, Science, 186, 155—156 (1974)].
Дополнение 10-Г
Семейство витамина К
В 1929 г. Г. Дэм установил, что одним из необходимых компонентов пищи цыплят является «антигеморрагический фактор», обеспечивающий быстрое свертывание кровиа. Это жирорастворимое вещество, позднее названное витамином К, уже через 2—6 ч после введения животным или птицам с недостаточностью витамина К резко снижает время свертывания крови. Так, у цыплят с недостаточностью витамина К время свертывания крови составляло свыше 240 с, а через 6 ч после инъекции 2 мкг витамина К это время снижалось до 75±27 сб.
Чистый витамин (рис. 10-8) 1,4-нафтохинон был выделен из люцерны в 1939 г. Вскоре было установлено существование двух его семейств, филлохинонов (витамин K1) и менахинонов (витамин К2). Филлохиноны содержат в боковой цепи четыре изопреноидных звена и встречаются в растениях; у животных и бактерий имеются менахиноны с пятью изопреноидными звеньями (рис. 10-8). Функцию витамина может также выполнять синтетический менадион (витамин К3, табл. 10-3).
Единственная установленная функция витамина К — это его связь со свертыванием крови. Как удалось проследить, недостаточность витамина К приводит к понижению содержания протромбина (рис. 6-16), некоторых факторов свертывания крови (факторов VII, IX и X) н одного плазматического белка, функция которого пока еще не установлена. В 1972 г. было обнаружено, что дефектный протромбин, образующийся в печени в отсутствие витамина К, не способен связывать ионы кальция, необходимые для последующего связывания протромбина с фосфолипидами и активации его в тромбин. Основываясь на этих сведениях, удалось локализовать структурные различия между нормальным и дефектным белком в N∙ концевом участке этого гликопротеида, содержащего ~560 остатковв. Из триптических гидролизатов нормального и дефектного протромбина были выделены пептиды, различающиеся по электрофоретической подвижности. Тщательный химический анализ в сочетании с изучением ЯМР-спектров показал, что в нормальном протромбине остатки в положениях 7, 8, 15, 17,20, 21, 26, 27, 30 и 33, которые при определении аминокислотной последовательности были все идентифицированы как глутаминовая кислота, в действительности являются остатками карбоксиглутамата.
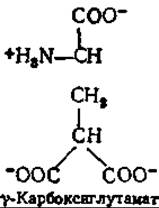
То обстоятельство, что у-карбоксиглутамат ранее никогда в белках не находили, объясняется легкостью, с которой это производное малоновой кислоты подвергается декарбоксилированию в обычную глутаминовую кислоту. Функция витамина К заключается в том, что он содействует включению дополнительных карбоксильных групп в остатки глутамата в предобразованном протромбине. По-видимому, аналогичной посттранскрипционной модификации подвергаются и другие факторы свертывания кровиг. Вызванное такой модификацией повышение способности к связыванию ионов кальция легко объясняется введением дополнительных карбоксилатных анионных групп, поскольку тем самым увеличивается число имеющихся в белке хелатных центров связывания металла.
Интересная особенность метаболизма витамина К выявилась при исследовании причин летальных кровоизлияний, развивающихся у скота, питавшегося испорченным сладким клевером. Причиной этого заболевания оказался дикумарол, производное кумарина, обычно присутствующее в клевере. Дикумарол и близко родственный с ним варфарин являются оба сильными антагонистами витамина К.
Интересно, что варфарин одновременно используется и как крысиный яд, и как лекарство при тромбоэмболических заболеваниях. Применение оксикумариновых средств против грызунов достаточно безопасно, так как случайный однократный прием яда ребенком или животным не приносит большого вреда, тогда как регулярное потребление оксикумаринов грызунами приводит к гибели последних. В организме животных витамин К, по всей вероятности, подвергается окислительному превращению в филлохинон-2,3-эпоксид. Последний в печени превращается в филлохинон, а кумариновые антикоагулянты ингибируют это обратное превращение. Эти вопросы имеют большое практическое значение, так как и в Европе, и в Соединенных Штатах распространены крысы, устойчивые к варфарину. Полагают, что эта устойчивость является следствием мутации, которая так изменяет фермент, превращающий эпоксид обратно в филлохинон, что он теряет чувствительность к ингибирующему действию варфаринад.

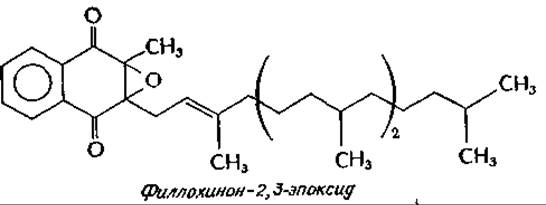
Хотя в механизме участия витамина К в карбоксилировании остатков глутамата еще много неясного, какие-то ключи к разгадке этого механизма удалось получитье. По-видимому, необходима гидрохинонная форма витамина, а также О2. Тот же препарат макросом, который катализирует карбоксилирование, вызывает также и образование филлохинон-2,3-эпоксида, а варфарин ингибирует карбоксилирование. Это указывает на наличие механизма, аналогичного механизму действия гидроксилаз, в ходе которого происходит образование и восстановление эпоксида витамина К. Возможно, что при образовании эпоксида из гидрохинона (вероятно, с промежуточным образованием перекиси) второй атом кислорода молекулы О2 освобождается как ОН- вблизи от у-метиленовой группы остатка глутаминовой кислоты, которая подвергается карбоксилированию. Этот гидроксил-ион может оттягивать на себя протон метиленовой группы, облегчая ее карбоксилирование такими реагентами, как карбонилфосфат (гл. 8, разд. В).
Насчет каких-либо других функций витамина К в организме человека, ничего неизвестно. Нафтохиноновое кольцо может служить окислителем в, системе переноса электронов
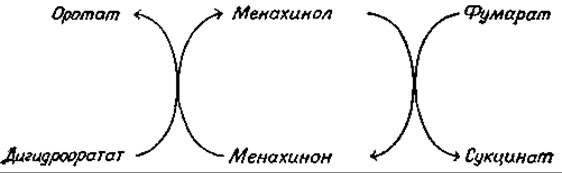
в некоторых бактериях. Кроме того, постулируется, что в бактериях менахинон выполняет роль специфического кофермента при превращении дигидрооротата в оротат; при этом роль окислителя выполняет фумаратж (гл. 14, разд. Л,1).
а Wasserman R. Н., Taylor А. N.. Annu. Rev. Biochem., 41, 179—202 (1972).
б Olson R. E., Science, 145, 926—928 (1964).
в Stenflo J., JBC, 251, 355—363 (1976).
г Howard J. B., Nelsestuen G. L, PNAS, 72, 1281—1285 (1975).
д Bell R. G., Caldwell P. T., Biochemistry, 12, 1759—1762 (1973).
e Sadowski J. A., Esmon С. T., Suttie J. W., JBC, 251, 2770—2776 (1976).
ж Newton N. A., Cox G. B., Gibson F., BBA, 244, 155—166 (1971).