Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Регуляция процессов биосинтеза
Фосфофруктокиназа - ключевой регуляторный фермент
В большинстве клеток метаболические взаимопревращения глюкозо-1-фосфата, глюкозо-6-фосфата и фруктозо-6-фосфата достигают состояния равновесия или сильно приближаются к равновесию. Что же касается фосфорилирования фруктозо-6-фосфата до фруктозо-1,6-дифосфата за счет АТР (рис. 11-11, наверху, в центре), то оно обычно далеко не достигает равновесия. Этот факт был установлен сравнением величины отношения действующих масс
[Фруктозодифосфат] [АРР]/[Фруктозо-6-фосфат] [АТР],
измеренной в тканях с известной величиной константы равновесия этой реакции. В случае равновесия эти две величины должны быть равны (разд. В,3). Экспериментальные методы определения четырех метаболических концентраций в тканях (необходимых для оценки отношения действующих масс) представляют интерес, в связи с чем мы кратко остановимся на них. Ткани должны быть очень быстро заморожены. Чаще всего это делают, сжимая их между двумя массивными алюминиевыми пластинками, охлаждаемыми жидким азотом1). Этим методом ткани удается охлаждать до —80 °С быстрее чем за 0,1 с. Замороженные ткани размельчаются, обрабатываются охлажденным агентом, денатурирующим белки, таким, как, например, хлорная кислота, и анализируются.
Для реакции, катализируемой фосфофруктокиназой, отношение действующих масс в сердечной мышце оказалось равным 0,03 [45], что значительно меньше константы равновесия, которая равна 3000 (вычислена из значения ∆G(pH7) = —20,1 кДж∙моль-1). Поскольку эта практически необратимая реакция в тканях очень далека от равновесия, фосфофруктокиназу можно рассматривать как фермент, лимитирующий общую скорость гликолиза (гл. 6, разд. Е,1). В соответствии с этой ролью фосфофруктокиназы становится понятным тот факт, что этот фермент чувствителен к действию различных аллостерических ингибиторов и активаторов (рис. 11-11)2). Фосфофруктокиназа ингибируется высокими концентрациями АТР; АМР же оказывает активирующее действие.
Таким образом, критическим фактором в регуляции этого фермента, так же как и многих других ферментов, участвующих в процессах гликолиза и глюконеогенеза, является стадия фосфорилирования адениловой системы. Имеются основания считать, что эту первую и наиболее важную стадию гликолиза «включает» АМР. Состояние адениловой системы оказывает влияние также на последующие стадии при гликолизе и в цикле трикарбоновых кислот. Таким образом, уменьшение концентрации АТР вызывает ингибирование процесса окисления пирувата и изоцитрата. Кроме того, в начальной стадии фосфоролиза гликогена и при окислении триозофосфатов необходимо наличие неорганического фосфата. Следовательно, быстрое потребление АТР клеткой (например, при мышечном сокращении) приводит к уменьшению концентрации АТР и увеличению концентрации АМР и Pi. Все эти изменения активируют процесс гликолиза. Однако, если мышечная активность прекращается и содержание АТР возрастает, наблюдается ингибирование сразу нескольких стадий гликолиза (рис. 11-11).
1) Детали см. в книге Ньюсхолма и Старта [45].
2) Из аллостерических ингибиторов, оказывающих влияние на этот фермент, можно указать на ионы цинка, константа связывания для которых равна приблизительно 0,3 мкм [46а].
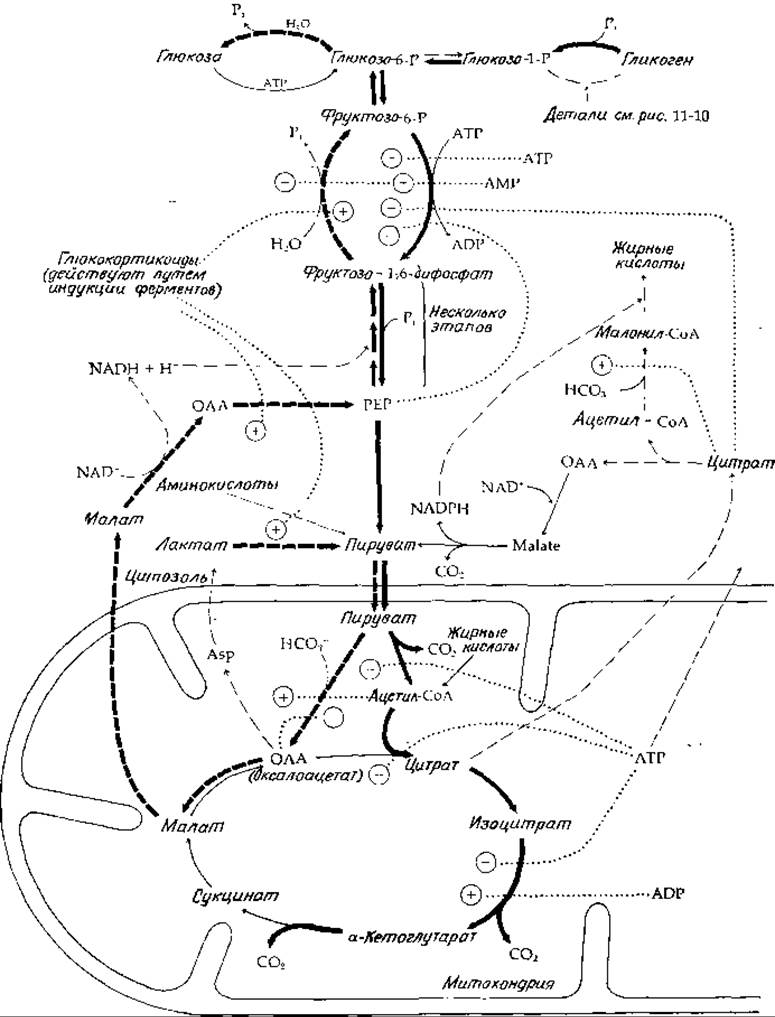
РИС. 11-11. Сопряженные друг с другом пути гликолиза, глюконеогенеза и окисления жирных кислот, а также синтезов с указанием некоторых способов регуляции: (→) — реакции гликолиза и окисления, протекающие через цикл трикарбоновых кислот. Сплошные жирные стрелки указывают путь углерода от гликогена (верхний правый угол) к СО2. (→) — биосинтетические пути. Прерывистые жирные стрелки означают глюконеогенезный путь от пирувата через оксалоацетат и малат.