Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Механизмы ферментативного катализа
Переходное состояние
Кинетические исследования дают представление о скорости работы ферментов, однако ничего не говорят о том, как ферменты катализируют реакции, т. е. не позволяют судить о механизме катализа. Под механизмом мы подразумеваем полное описание стадий, через которые протекает реакция. Большинство стадий включает разрыв одной химической связи и одновременное образование другой. Рассмотрим, например, реакцию простого замещения, в которой гидроксил-ион реагирует с иодистым метилом с образованием в качестве продуктов метанола и иодид-иона:
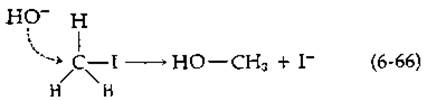
В ходе реакции гидроксил-ион «атакует» атом углерода метильной группы и одновременно «вытесняет» иодид-ион.
Химическая реакция, подобная представленной на схеме (6-66), протекает отнюдь не мгновенно, в ходе нее происходит постепенное растяжение и частичный разрыв связи С—I и одновременное образование новой, С—О-связи. Такая промежуточная структура отличается от структуры обычных соединений и энергетически менее устойчива, чем исходные соединения и продукты. Называется она переходным состоянием. Для реакции замещения, представленной на схеме (6-66), структура переходного состояния может быть изображена следующим образом:
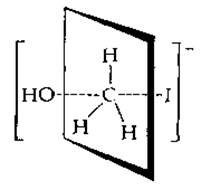
Отрицательный заряд распределяется между атакующей ОН-группой и вытесняемым иодидом. Заметим, что расположение связей около центрального углеродного атома не является больше тетраэдрическим: С—Н-связи лежат в одной плоскости, а связи, обозначенные пунктиром, с ОН-группой и атомом I расположены под прямым углом к этой плоскости.
При обсуждении механизма реакции полезно построить диаграмму переходного состояния, которая показывает, как изменяется свободная энергия1)G вдоль координаты реакции (рис. 6-12, Л). Координата реакции не имеет строгого физического смысла.
Она лишь отражает переход от исходных веществ к продуктам и характеризует степень растяжения и разрыва существующей связи или степень образования новой. Точка с наибольшей энергией соответствует переходному состоянию.
Более полное представление об этом состоянии можно получить из диаграмм, аналогичных представленной на рис. 6-12, Б. Здесь изображены линии равной свободной энергии как функции длин двух связей. Для реакций (6-66) по оси ординат отложена длина вновь образующейся связи С— — —О, а по оси абсцисс — длина разрывающейся связи С — — —І. Пунктирная
линия, которая проходит через «седловину», соответствующую переходному состоянию, представляет собой геометрическое место точек с минимальной энергией.
Разность значений свободной энергии (G) для исходных реагентов и продуктов на диаграмме переходного состояния соответствует полному изменению свободной энергии (∆G) для изучаемой реакции, а разность значений свободной энергии для исходных реагентов и переходного состояния соответствует свободной энергии активации (∆G*). ∆G≠ представляет собой «энергетический барьер», который необходимо преодолеть для того, чтобы произошла реакция; этой величиной в основном и определяется скорость реакции.
Диаграммы переходного состояния для ферментативных реакций, протекающих обычно через несколько промежуточных стадий, не так просты, как диаграмма, изображенная на рис. 6-12. Они включают несколько переходных состояний (каждое из которых соответствует определенной стадии), разделенных «ямами» (соответствующими промежуточным соединениям, в некоторых случаях весьма нестабильным). Переход от исходных реагентов к продуктам в ходе ферментативной реакции можно уподобить путешествию с преодолением горных хребтов различной высоты, которое заканчивается выходом на равнину.

РИС. 6-12. А. Диаграмма переходного состояния, иллюстрирующая изменение свободной энергии вдоль координаты реакции для превращения исходных веществ в продукты в ходе химической реакции. Б. Поверхность свободной энергии в пространстве связей для реакции В+Х—А→-ВХ+А.
1) По оси ординат можно отложить также энергию Е или энтальпию Н. Авторы часто даже не оговаривают, какую именно величину (G, Е или Н), они откладывают.