Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Замещение у атома фосфора
Фосфатазы
Нуклеофильное замещение у атома фосфора (табл. 7-1, реакция типа 1.В) — очень важный тип реакций ввиду большого числа участвующих в этом процессе ферментов и их центральной роли в энергетическом метаболизме.
Фосфатазы катализируют гидролиз фосфорных эфиров с образованием неорганического фосфата:
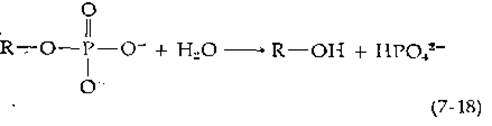
или в сокращенном виде
![]()
Две группы ферментов, кислые и щелочные фосфатазы, представляют собой неспецифические ферменты, которые способны расщеплять большое число различных эфиров фосфорной кислоты. Другие же фосфатазы, например глюкозо-6-фосфатаза и фруктозо-1,6-дифосфатаза, проявляют избирательную специфичность по отношению к какому-то одному субстрату. Функция неспецифических фосфатаз не совсем ясна. Щелочные фосфатазы найдены в бактериях, грибах и в тканях высших животных, но не у высших растений. Оказалось, что в клетках Е. coli щелочная фосфатаза находится преимущественно в периплазматическом пространстве. Фермент обнаружен в щеточной каемке эпителия почечных канальцев, в клетках кишечного эпителия, в остеоцитах и остеобластах. Щелочная фосфатаза почти полностью отсутствует в эритроцитах, в мышцах и других тканях, не принимающих активного участия в транспорте питательных веществ. Существует теория, согласно которой этот фермент обеспечивает образование неорганического фосфата там, где в нем возникает потребность. Щелочная фосфатаза Е. coli представляет собой димер с мол. весом ~ 89 000, который требует ионы Zn2+, аллостерически активируется Mg2+ и имеет pH-оптимум выше 8 [49]. Инкубация фермента с неорганическим фосфатом при рН~4 приводит к образованию фосфофермента. В опытах с фосфатом, меченным 32Р, было установлено, что фосфат присоединяется к реакционноспособному остатку серина в последовательности
![]()
Точно такая последовательность обнаружена и в щелочных фосфатазах млекопитающих (причем для этих ферментов характерна такая же потребность в ионах металла) [50]. Эта последовательность аналогична последовательности аминокислот в активных центрах сериновых протеиназ с той лишь разницей, что у щелочных фосфатаз вместо остатка глицина стоит аланин. Возможно, эти две группы ферментов эволюционировали от общего белка-предшественника [51].
Для щелочной фосфатазы из Е. coli характерно, что в каждый момент времени работает только один из активных центров. Исходя из такого поведения фермента, было сделано допущение [52] о кооперативном взаимодействии субъединиц, приводящем к согласованному изменению каталитической эффективности активных центров качательный механизм («flip-flop» mechanism); см. гл. 8, разд. 3,3]. Однако это допущение было подвергнуто сомнению [53].
Кислые фосфатазы имеют pH-оптимум ~5 и ингибируются фторид ионом. Они встречаются как в тканях растений, так и в тканях животных. В костях высокое содержание кислых фосфатаз обнаружено в ос теокластах, функция которых состоит в поглощении кальция из костной ткани. Фосфофермент был получен в случае щелочных фосфатаз как растительного, так и животного происхождения [54, 55]. При кратко временной инкубации фермента в присутствии меченного 32Р n-нитрофенилфосфата с последующим воздействием щелочной денатурирующе среды был получен ковалентно меченный белок. После щелочного гидролиза этого белка был выделен N1-фосфогистидин, содержащий 32Р:
Пирофосфатазы, имеющиеся во всех клетках, катализируют гидролиз неорганического пирофосфата с образованием двух молекул Pi (дополнение З-A). Очень активная пирофосфатаза Е. coli имеет число оборотов выше 2∙10-4 с-1 при 37°С. Для того чтобы быстро гидролизовать пирофосфат, образующийся в результате бактериального метаболизма, достаточно 1000 молекул фермента на одну клетку [56].