Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции замещения у карбонильных групп
Ацилтрансферазы
В биосинтетических реакциях ацильные группы часто переносятся от амидов или сложных эфиров к различным акцепторам. Например, конечной стадией в образовании пептидных связей в процессе синтеза белка на рибосомах является перенос пептидильной группы, присоединенной при помощи эфирной связи к молекуле тРНК, к аминогруппе «активированной» аминокислоты (гл. 11, разд. Д,1).
Стадия трансацилирования (транспептидации) является также последней стадией в синтезе пептидогликанов бактериальных клеточных стенок. Аминогруппа диаминокислоты (рис. 5-9) одной пептидной цепи атакует амидную связь соседней цепи. При этом происходит замещение молекулы D-аланина и образуется поперечная связь (дополнение 7-Г). Ацильные группы, особенно ацетильные, часто переносятся на вуклеофильные центры тиоэфиров кофермента А (гл. 8, разд. Б). Примером может служить образование ацетилхолина (дополнение 7-Б) из холина и ацетил-СоА в процессе реакции трансацетилирования. Заметим, что присущая тиоэфирам высокая эффективность переноса групп обеспечивает полноту протекания реакций.
Дополнение 7-Г
Пенициллины и родственные антибиотикиa

Пенициллин (из гриба Penicilium был первым антибиотиком, нашедшим практическое применение в медицине. Промышленное получение его было начато в начале 40-х годов. Бензилпенициллин (пенициллин G) — один из нескольких природных пенициллинов, различающихся природой группы R (см. структуру, изображенную выше),— стал одним из важнейших лекарственных средств. Он особенно эффективен против грамположительных бактерий, однако в больших концентрациях может атаковать и грамотрицательные бактерии, включая Е. coli.
Широко известный полусинтетический пенициллин, ампициллин (R = D-а-аминобензил), является антибиотиком с широким спектром действия; он может атаковать как грамположительные, так и грамотрицательные организмы. Ампициллин, так же как и пенициллин, обладает очень низкой токсичностью, однако может вызывать аллергические реакции. Другие полусинтетические пенициллины устойчивы к действию пенициллиназ. Эти ферменты, продуцируемые устойчивыми к пенициллину бактериями (гл. 15, разд. Г,7), расщепляют четырехчленное ß-лактамное кольцо природных пенициллинов и инактивируют их.
Пенициллин поражает только растущие бактерии, препятствуя правильному поперечному сшиванию слоя пептидогликана в бактериальных клеточных стенках (гл. 5, разд. Г). Аминогруппа из диаминокислоты одной пептидной цепи пептидогликана замещает D-аланиновую группу в реакции транспептидации (трансацилирования):

Было высказано предположение, что пенициллины являются структурными аналогами D-аланил-D-аланина и связываются в активном центре трансацилазыб-в. ß-Лактамное кольцо пенициллинов нестабильно, что делает пенициллины сильными ацилирующими агентами. Если предположить, что трансацилаза работает по механизму двойного замещения, то начальная атака пенициллина, связанного в активном центре трансацилазы нуклеофильной группой фермента, должна привести к образованию неактивного пеницnллиноилированного фермента. Экспериментальные данные не только подтверждают предположение о таком механизме действия пенициллина, но и позволяют сделать заключение, что он модифицирует более чем один белок; следовательно, могут быть другие точки воздействия пенициллинаб,г,д.
Тесно связан с пенициллином еще один антибиотик, цефалоспорин С.
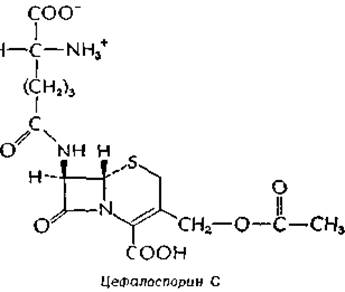
Он содержит D-a-аминоадипоильную боковую цепь, замещая которую другими группами можно получить различные полусинтетические цефалоспорины.
а Hoover J. R. Е., Stedman R. J. (1970). In: Medicinal chemistry (A. Burger, ed.), 3rd ed., Part I, pp. 371—408. Wiley (Interscience), New York.
б Blumberg P. M., Strominger J. L. (1972). J. Biol. Chem., 247, 8107— 8113.
в Gale E. F., Cundliffe E., Reynolds P. E., Richmond M. H., Waring M. J. (1972). The molecular basis of antibiotic action. Wiley, New York.
г Blumberg P. M., Strominger J. L. (1974). Bacteriol. Rev., 38, 291—375.
д Spratt B. G., Pardee A. B. (1975). Nature (London), 254, 516—517.