Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции замещения у карбонильных групп
Участие ионов металла в действии протеиназ: карбоксипептидаза А
В соке поджелудочной железы помимо трипсиногена и химотрипсиногена содержатся другие зимогены, которые превращаются в ферменты, отщепляющие аминокислоты от концов пептидных цепей (экзопептидазы) и в отличие от эндопептидаз — трипсина и химотрипсина — не способные расщеплять пептидные связи, находящиеся внутри полипептидной цепи. Карбоксипептидазы атакуют только С-концевые группы, отщепляя последовательно по одной аминокислоте, что делает ее ценным инструментом при определении аминокислотной последовательности в пептидах. Карбоксипептидазы используют также для модификации белков путем удаления одной или нескольких аминокислот от С-конца. Главной особенностью карбоксипептидазы А является наличие в ее молекуле прочно связанного иона цинка. Он может быть удален из белка и замещен ионами других металлов, что в некоторых случаях сопровождается восстановлением ферментативной активности.
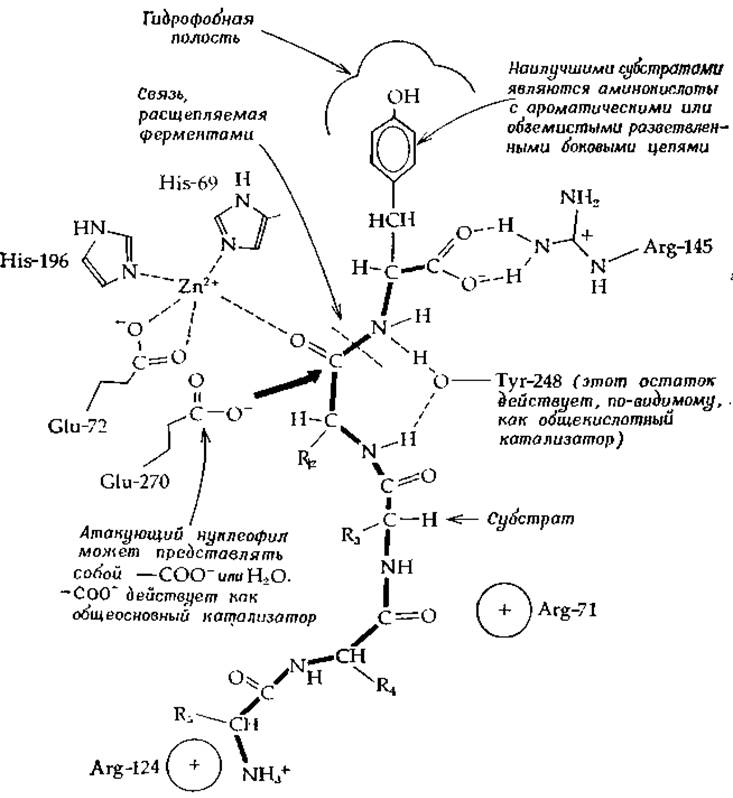
РИС. 7-3. Строение активного центра карбоксипептидазы А, содержащего связанный пептидный субстрат (по Липскому [44—46]).
После обнаружения иона цинка в карбоксипептидазе сразу же было высказано предположение об его участии в катализе. В отличие от протонов, имеющих слабое сродство к кислороду амидной карбонильной группы, ион металла может образовать сильный комплекс. Если положение металла фиксировано другими лигандами белковой молекулы, то можно ожидать, что расположенный соответствующим образом ион цинка будет существенно увеличивать электрофильную природу атома углерода С=О-группы. Трехмерная структура карбоксипептидазы А пока еще не уставовлена, во исследования по дифракции рентгеновских лучей кристаллами фермента подтвердили предположения относительно роли иона цинка и позволили углубить наши представления о механизме ферментативной реакции [44—46].
Ион цинка образует хелатные связи с двумя имидазольными группами и боковой цепью глутаминовой кислоты (рис. 7-3). Остатки Arg-245 и Туr-248 образуют водородные связи с субстратом, причем последний выступает в роли общего кислотного катализатора, участвующего в протонировании уходящей группы. В роли атакующего нуклеофила выступает, по-видимому, либо карбоксилатная группа остатка Glu-270, либо молекула воды. В первом случае в качестве промежуточного продукта должен образоваться ангидрид. Наличие гидрофобного «кармана» объясняет специфичность фермента по отношению к С-концевым аминокислотам с объемистыми гидрофобными боковыми цепями.
Другая цинксодержащая протеиназа термолизин, продуцируемый Bacillus łhermoproteolyticus, — фермент, обладающий заметной термостабильностью. Он содержит также четыре связанных иона кальция [47, 48].