Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Замещение у атома фосфора
Ядерная релаксация, индуцированная парамагнитными ионами
Использование парамагнитных ионов (например, Mn2+, Сu2+ или Сr3+) для индукции ядерной релаксации в молекулах субстрата и кофермента, находящихся в активных центрах ферментов, является очень эффективным методом исследования. Область применения этого метода непрерывно расширяется [79—83]. Для этих целей могут служить также флавиновые радикалы и избирательно вводимые иминоксильные спиновые метки. Парамагнитные ионы, как хорошо известно, оказывают влияние на магнитную релаксацию соседних ядер (см. дополнение 5-А). Так, небольшие количества Мn2+ в образце вызывают уширение линий, соответствующих 1Н, 13С и 31Р в обычных спектрах ЯМР.
Ценную информацию о ферментах можно иногда получить из анализа сигнала ЯМР протонов в воде (растворителе). Время релаксации протонов свободной воды обычно больше 1 с. Однако протоны координационно связанных молекул воды в ионе Мn(Н2O)2+6 характеризуются гораздо более высокими скоростями релаксации (значения T1и Т2 порядка 10-5 с). Поскольку координационно связанные молекулы воды обычно очень быстро обмениваются с молекулами окружающей среды, небольшое количество ионов марганца может вызвать существенное повышение скорости релаксации протонов всех молекул воды. При этом с помощью подходящих методов можно наблюдать уширение линии протона в спектре ЯМР и изменения величин Т1 и Т2. Известно, что сила воздействия парамагнитного иона на магнитную релаксацию соседнего ядра обратно пропорциональна межъядерному расстоянию в шестой степени. Принимая, что в гидратированном ионе Мn2+ расстояние между Мn2+ и Н равно 0,287+0,005 нм, можно найти количественные соотношения между изменениями величин T1и Т2, с одной стороны, и числом молекул воды, входящих в координационную сферу связанного белком иона металла в любой фиксированный момент времени, и скоростью их обмена с молекулами растворителя, с другой стороны.
Хотя регистрация изменений магнитной релаксации ядер 1Н, 13С и 31Р наталкивается на еще большие трудности, подобные измерения могут дать чрезвычайно полезную информацию о геометрии активных центров. Расчеты опираются на ту закономерность, что воздействие на релаксацию ядра убывает с ростом межъядерного расстояния r пропорционально 1/r6. Хотя теория этих явлений очень сложна, при определенных условиях соответствующие уравнения упрощаются и принимают вид
r = C[T1Мf(тс)]1/6, (7-24)
где r — межъядерное расстояние; С — постоянная, представляющая собой определенную комбинацию физических констант; T1M — время продольной релаксации, индуцированной парамагнитным ионом; f(тc) — сложная функция, зависящая от времени корреляции тс (наблюдение ведется за резонансной частотой ядра) и частоты прецессии спинов электронов в парамагнитных центрах. Существует целый ряд методов для оценки тс и величины r при помощи уравнения (7-24).
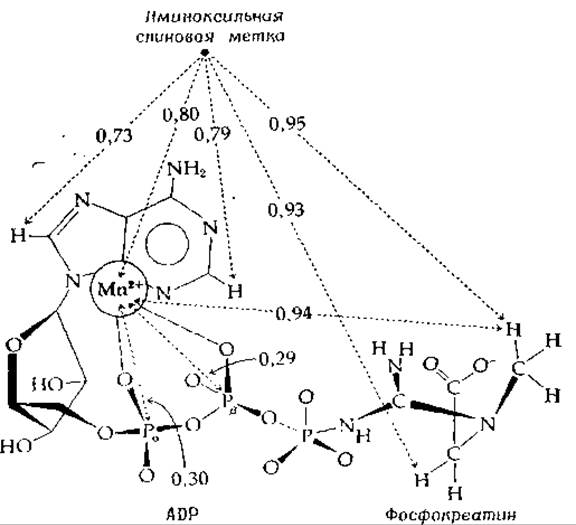
РИС. 7-6. Структура комплекса креатинкиназа — Мn2+—ADP — креатинфосфат (по Мак-Лафлину и др. [84]). Расположение субстратов показано в соответствии с расстояниями, измеренными методами магнитного резонанса.
Один из примеров подобных исследований [84] представлен на рис. 7-6. Спектры ЯМР связанного иона Мn2+ и иминоксильной спиновой метки были измерены с использованием импульсного спектрометра на 220 Мгц. Кроме того, регистрация спектров ЭПР позволила определить расстояние между Мn2+ и иминоксильным радикалом. Ион марганца связан с а- и ß-фосфатами ADP подобно тому, как это показано на схеме (7-23).
Были приготовлены также комплексы ADP и АТР с Сr3+, которые были испытаны как субстраты в различных ферментативных реакциях. Оказалось, что киназы совершенно не активны в отношении этих комплексов; возможно, это объясняется неправильным или слишком прочным связыванием иона Сr3+. По-видимому, в ходе каталитического процесса происходит перемещение иона или окружающих его групп на некоторое расстояние, а в случае комплексов с Сr3+ это движение оказывается заблокированным.
Дополнение 7-Д
Магний
Взрослый человек в среднем ежедневно получает 10—12 ммоль ионов магния (∼1/4 г). Из этого количества примерно одна треть всасывается из пищеварительного тракта. Для поддержания гомеостаза эквивалентное количество магния выделяется с мочой. Шестьдесят процентов магния в организме находится в костях. Концентрация Mg2+ в сыворотке крови составляет ~0,85 мМ. В то же время в тканях общая концентрация магния составляет 5—8 мМ. Однако только ~ 1 мМ Mg2+ находится в организме в свободном виде. Остальная часть магния связана с белками и растворимыми соединениями, такими, как ATP, ADP и другие фосфат- и карбоксилатсодержащие соединения.
Было высказано предположение, что концентрация ионов Mg2+, так же как и концентрация ионов Н+, остается в состоянии подвижного равновесия с сывороткой крови3. Тем не менее, по-видимому, возможны ситуации, когда происходят по крайней мере временные изменения концентрации свободных ионов Mg2+ и свободных ионов Н+б. При быстром катаболизме углеводов гликолиз может привести к закислению мышечных клеток, причем значение pH может падать от 7,3 до 6,3. Падение pH вызывает значительное снижение степени связывания Mg2+ с такими молекулами, как АТР, и временное увеличение концентрации ионов Mg2+. Подобным образом высвобождение дифосфоглицерата из комплекса с гемоглобином при оксигенации приводит к снижению концентрации свободного Mg2+, так как последний связывается с дифосфоглицератомв. Эти изменения концентрации свободного Mg2+ могут иметь большое значение в метаболической регуляцииг.
Ион магния имеет меньший радиус по сравнению с ионом Са2+, чем и объясняется большая легкость, с которой он проникает в клетки. Часто роль Mg2+ может брать на себя Мn2+ при полном сохранении активности ферментов, требующих присутствия ионов Mg2+. В то же время высокие концентрации Са2+ часто антагонистичны по отношению к Mg2+. Этот антагонизмд отчетливо проявляется при изучении совместного влияния этих ионов на возбудимость клеток. Дефицит магния или избыток кальция в окружающей среде приводят к повышению возбудимости; с другой стороны, избыток магния приводит к ее потере. Интересно отметить, что для находящихся в состоянии зимней спячки животных характерно высокое содержание ионов Mg2+.
Функционирование многих ферментов связано с участием Mg2+, причем самую обширную самостоятельную группу представляют фосфотрансферазы (гл. 3, разд. Б,5), для которых MgАТР может рассматриваться как субстрат. К числу Mg2+ зависимых ферментов принадлежат фосфатазы и другие ферменты, катализирующие перенос фосфатных групп. Особая функция магния связана с его участием в фотосинтезе в качестве компонента хлорофилла.
Одним из наиболее токсичных металлов является бериллий. Оказалось, что в случае многих ферментов, в том числе фосфоглюкомутаз и фосфатаз, Ве2+ конкурирует с Mg2+ за связывание со специфическими центрами.
а Veloso D., Guynn R. W., Oskarrson M., Veech R. L. (1973). J. Biol. Chem., 248, 4811—4819.
б Purich D. L., Fromm H. J. (1972). Curr. Top. Cell. Regul., 6, 131—167.
в Bunn H. F., Ransil B. J., Chao A. (1971). J. Biol. Chem., 246, 5273—5279.
г Rubin H. (1975). Proc. Nat. Acad. Sсi. USA, 72, 3551—3555.
д Meli J., Bygrave F. L. (1972). Biochem. J., 128, 415—420.