Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Замещение у атома фосфора
Киназы
Большой класс ферментов катализирует перенос фосфатных групп от одного атома к другому1). К таким ферментам относятся киназы, т. е. ферменты, осуществляющие перенос фосфатных групп от полифосфатов, таких, как АТР, на атомы кислорода, азота или серы второго субстрата. Примером киназ может служить гексокиназа [уравнение (6-91); рис. 9-7] — фермент, ответственный за синтез глюкозо-6-фосфата из свободной глюкозы [уравнение (7-23)].
Гексокиназа, подобно большинству ферментов, катализирующих перенос фосфатных групп, проявляет абсолютную потребность в двухвалентном катионе, в роли которого добычно выступает ион Mg2+. Хотя истинным субстратом гексокиназы считается комплекс ATP с Mg2+, точный механизм комплексообразования металла с полифосфатом на поверхности фермента не известен. По-видимому, металл связывается и с группами фермента, и с группами субстрата.
Картина, приведенная в уравнении (7-23), носит гипотетический характер и иллюстрирует возможную функцию иона металла в этих реакциях. Взаимодействуя с двумя фосфатными группами молекулы АТР, которые становятся уходящими группами в реакции замещения, ион металла притягивает к себе электроны и облегчает расщепление связи. Согласно другому механизму, металл в комплексе ES располагается у концевой фосфатной группы (той, которая подвергается переносу), где он может служить для нейтрализации отрицательного заряда и облегчать приближение атакующего нуклеофила. Однако, если металл образует мостиковую связь между первым и вторым фосфатом, то возникает прочный хелатный цикл, который может только помешать протеканию этой реакции, а не облегчить ее. Таким образом, положение металла, показанное в уравнении (7-23), следует рассматривать просто как наиболее вероятное. Возможно, что и в рибонуклеазе некоторые основные группы фермента нейтрализуют отрицательный заряд на концевом фосфате.
1) Фосфатазы являются также и фосфотрансферазами, переносящими фосфатные остатки на гидроксильные ионы водной среды. Однако обычно такие ферменты относят к гидролазам, а не к трансферазам.

В уравнении (7-23) показан линейный тип атаки гидроксильной группой глюкозы. Этот механизм прямого одноактного замещения кажется вполне вероятным, поскольку никаких парциальных реакций обмена обнаружено не было. Более того, при изучении кинетики реакции не было получено данных о наличии пинг-понг-механизма, который бы свидетельствовал о промежуточном образовании фосфофермента. Тем не менее эту возможность нельзя исключить [74]. Можно допустить, что оба субстрата должны связаться в активном центре, прежде чем фермент приобретет конформацию, необходимую для осуществления катализа. Фосфорилированное промежуточное соединение фермента могло бы обладать исключительно высокой реакционноспособностью, что затрудняло бы его обнаружение. В случае некоторых фосфотрансфераз были получены относительно стабильные фосфоферменты путем их обработки у-32Р-АТР в отсутствие второго субстрата [75]. Милдваи [67] высказал предположение, что эти фосфоферменты образуются в результате побочных реакций, свидетельствующих о существовании промежуточных метафосфатных соединений.
Недавно описаны трехмерные структуры дрожжевой гексокиназы (рис. 7-5,А) [76], фосфоглицераткиназы, состоящей из 355 аминокислотных остатков (рис. 7-5,5) [77] и аденилаткиназы (дополнение 3-А) [78]. Последний фермент, мол. вес которого составляет ~ 22 000, имеет среди всех известных киназ наименьший размер молекулы. Во всех трех случаях молекула белка состоит из двух долей (или, иначе, доменов). Для фосфоглицераткиназы и аденилаткиназы установлено положение ATP-связывающего центра. Оказалось, что две ближние к аденозину фосфатные группы Ра и Рβ связываются одним и тем же доменом (нижний домен А на рис. 7-5, Б), а концевая фосфатная группа АТР (Ру) попадает в щель между двумя доменами. Ион Mg2+ связывается с Ра и Рβ так, как это показано на схеме (7-23).
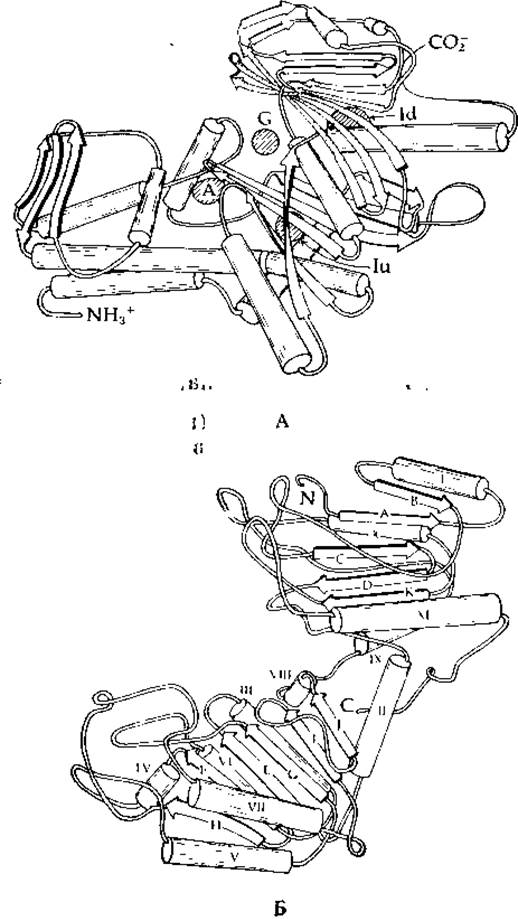
РИС. 7-5. А. Схематическое изображение полипептидной цепи субъединицы дрожжевой гексокииазы В. Место связывания глюкозы обозначено буквой G, а место связывания АМР — буквой А. Места связывания АТР в области между двумя субъединицами в различных типах кристаллов обозначены буквами Iu и Id (по Флеттерику и др. [76]). Б. Изображение молекулы фосфоглицераткиназы. Цилиндры, представляющие а-спиральные отрезки цепи, пронумерованы римскими цифрами, начиная с N-конца. Стрелками представлены индивидуальные цепи в ß-структуре и их направление. Стрелки обозначены буквами в алфавитном порядке, начиная с N-конца. Домен, связывающий АТР, находится в нижней части рисунка (по Блейку и Эвансу [77]).
Большой интерес в настоящее время вызывают протеинкиназы (гл. 6, разд. Е,2), которые катализируют перенос фосфатных групп от АТР к гидроксильным группам определенных остатков серина или треонина в молекулах своих субстратов. Характерной особенностью центров фосфорилирования в субстратных белках является присутствие остатка лизина или аргинина в положении, отделенном от серина или треонина только одним аминокислотным остатком [78а].
Планарный нитрат-ион по своему сильному ингибирующему действию, обусловленному прочным связыванием, и по ряду других свойств может рассматриваться как аналог переносимой фосфатной группы в тригональних бипирамидальных переходных состояниях [уравнение (7-20)] для реакций, катализируемых киназами [78b]. Еще один ион, представляющий интерес как высокореакционноспособный аналог фосфат-иона, — это феррат-ион FeO2-4. Будучи сильным окислительным агентом, феррат-ион сходен в то же время с фосфат-ионом по структуре и кислотно-основным свойствам и может быть использован для модификации фосфат-связывающих центров [78с].