Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Замещение у атома фосфора
Нуклеаза микрококков (стафилококков)
Гидролизующий полинуклеотиды бактериальный фермент, который широко используется для анализа ближайших соседей (гл. 2, разд. 3,4), может осуществлять гидролиз ДНК и РНК до 3'-нуклеотидов. Установлена трехмерная структура молекулы нуклеазы стафилококков, состоящей из 149 аминокислотных остатков [69—71]. Так же как и в случае панкреатической рибонуклеази, молекулу нуклеазы стафилококков можно расщепить на два активных пептида (фрагменты, построенные из остатков 6—48 и 49—149), которые, соединяясь, образуют комплекс, обладающий ферментативной активностью [71, 72]. Комплекс образуется даже в том случае, когда от меньшего пептида отщеплены остатки 43—48. Однако остаток Glu-43, который связывает имеющий существенное значение ион Са2+, необходим для проявления ферментативной активности [72], так же как и пептидная связь с соседним треонином (Тrе-44).
Определение трехмерной структуры кристаллической нуклеазы показывает, что большинство кислотных и основных боковых групп белка взаимодействует друг с другом, образуя кластеры водородных связей. Столь же интересно распределение водородных связей между ферментом и 5'-фосфатной группой специфического ингибитора — дезокситимидин-3',5'-дифосфата. Два концевых гуанидиний-иона остатков аргинина взаимодействуют с 5'-фосфатной группой (рис. 7-4). Ясно, что эти положительно заряженные группы как будто специально созданы для взаимодействия с фосфат-ионами и что их положительные заряды сильно поляризуют фосфатную группу и благоприятствуют нуклеофильной атаке. Кроме того, Arg-87 находится в положении, удобном для протонирования уходящей группы —О-.
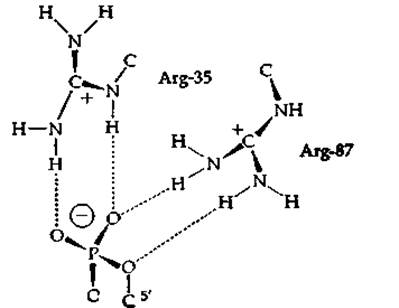
РИС. 7-4. Схема, демонстрирующая образование водородных связей между ионами гуанидиния остатков Arg-35 и Arg-87 нуклеазы стафилококков и 5'-фосфатной группой ингибитора—тимидин-3',5'-дифосфата в комплексе Е+1+Са2+ (по Коттону и др. [73]).
Как отметили Коттон и др. [73], способность к связыванию фосфатсодержащих молекул с белками — «неотъемлемое свойство химии живых систем». Особый интерес представляет природа связывания. Боковые группы остатков аргинина могут образовывать до пяти водородных связей каждая и способны одновременно взаимодействовать с фосфатными группами и с другими группами белковой молекулы. Например, в нуклеазе стафилококков Arg-35 образует связи как с фосфатом, так и с карбонильной группой полипептидной цепи.