Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции присоединения и элиминирования
Карбоангидраза
Одна из простейших реакций присоединения — это гидратация СО2, приводящая к образованию бикарбонат-иона:
![]()
Если эту реакцию проводить в отсутствие катализатора, то на нее потребуется несколько секунд [101]; кажущаяся константа скорости первого порядка составляет ~0,03 с-1 при 25 °С. Когда этот процесс протекает в клетках, он часто ускоряется. Специфический катализатор, карбоангидраза, — широко распространенный фермент, проявляющий особенно высокую активность в клетках и тканях, участвующих в процессах дыхания (например, в эритроцитах). В 1 л крови млекопитающих содержится 1—2 г этого фермента, представляющего собой мономерный белок (с мол. весом ~30 000), в молекуле которого содержится ~260 аминокислот и один прочно связанный ион Zn2+. Трехмерные структуры двух основных изоферментов, выделенных из крови человека, были установлены методом дифракции рентгеновских лучей [102, 103]. Обе молекулы имеют эллипсоидную форму размерами ~ 4,1∙4,1∙4,7 нм. Атом цинка в молекуле каждого изофермента расположен в глубоком кармане, расположенном на расстоянии ~ 1,2 нм от поверхности, и окружен тремя боковыми группами гистидина и одной молекулой Н2О или ОН--группой. Четыре лиганда образуют скошенный тетраэдр (рис. 7-8).
Одна из имидазольных групп (остаток His-119), координационно связанная с атомом цинка, образует водородную связь с карбоксильной группой боковой цепи остатка Glu, а эта карбоксильная группа в свою очередь образует еще более разветвленную сеть водородных связей, часть которых показана на рис. 7-8. Эта структурная особенность, напоминающая систему переноса заряда в химотрипсине, может усиливать сродство имидазола-119 к атому металла, а также может влиять на каталитические свойства фермента. Другие имидазольные группы также образуют водородные связи с группами белковой молекулы.
Карбоангидраза — один из наиболее активных среди известных ферментов. Реакция гидратации СO2 при 25°С характеризуется числом оборотов ~ 106 с-1. Тот же самый фермент катализирует гидратацию ацетальдегида [уравнение (7-35)], однако эта реакция протекает в 1000 раз медленнее. Активность контролируется состоянием ионизации группы с рKа ≈ 7. Согласно наиболее распространенной теории, предполагается, что ион цинка связывает молекулу воды и что комплекс Zn—ОН2 теряет протон, образуя Zn+—ОН (процесс потери протона комплексом Zn—ОН2 характеризуется рКа≈ 7, т. е. необычно низкой величиной рKа, что, возможно, связано с гидрофобным окружением [104, 104а]). Zn+—ОН по существу представляет собой стабилизированный гидроксильный ион, существующий при тех значениях pH, при которых ОН- обычно имеется в очень небольшом количестве. Именно этот гидроксильный ион и присоединяется к СO2 или к альдегидному субстрату. Таким образом, роль Zn2+ в этом ферменте состоит в генерировании атакующего основания, а не в поляризации карбонильной группы. Последнюю функцию выполняет ион Zn2+, входящий в состав активного центра карбоксипептидазы (гл. 7, разд Г,4).
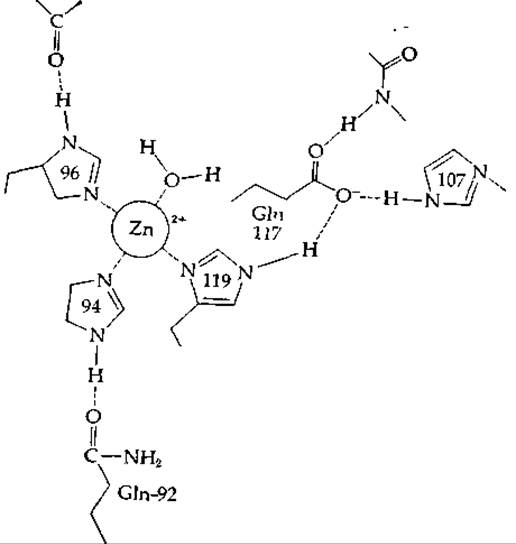
РИС. 7-8. Хелатированный атом цинка в активном центре карбоангидразы В человека (по Каннану и др. [103]).
Реакциям, катализируемым карбоангидразой, родственна реакция! присоединения аминогруппы молекулы гемоглобина к СO2 с образованием карбаминогрупп (—NH—СОО-) (гл. 4, разд. Д,6).
Дополнение 7-Е
Цинк
В среднем человек поглощает 10—15 мг цинка в день3. Несмотря на то что цинк всасывается плохо, его концентрация в тканях относительно высока, причем этот металл имеет очень важное значение для активности многих ферментов. Общее содержание цинка в организме человека весом 70 кг составляет 1,4—2,3 г. Типичная концентрация ионов Zn2+ в тканях равна 0,3—0,5 мМ; необычно высокая концентрация (~15 мМ) обнаружена в предстательной железе.
Ион цинка гораздо прочнее связывается с большинством органических лигандов, чем ион Mg2+ (табл. 4-2). Он имеет заполненную 3d-орбиту и стремится образовать четыре ковалентные связи тетраэдрической симметрии, часто с азот- или серусодержащими лигандами. В отличие от Mg2+, который быстро и обратимо взаимодействует с ферментами, Zn2+ обнаруживает тенденцию к образованию прочных связей внутри металлоферментов. В настоящее время известна трехмерная структура некоторых металлоферментов. Во всех этих ферментах ион Zn2+ в активном центре окружен тремя имидазольными группами, а четвертая координационная связь остается свободной для взаимодействия с субстратом. Значительный интерес представляет также и тот факт, что второй атом азота имидазольной группы во многих случаях образует водородную связь с карбонильной группой в основной цепи пептидаб. Такое же свойство обнаружено и для атомов железа гемсодержащих белков (рис. 10-1).
Несомненно, что с химической точки зрения Zn2+ в ферментах выполняет роль льюисовской кислоты, создающей локализованный центр положительного заряда вблизи нуклеофильного центра субстратав. Эта функция иона металла обсуждается в разд. Г,4 при рассмотрении карбоксипептидазы (рис. 7-3). Ионы цинка необходимы также для функционирования термолизина (разд. Г,4), дипептидаз, щелочной фосфатазы (разд. Д,1), РНК-полимераз, ДНК-полимеразг, карбоангидразы (рис. 7-8), альдолаз класса II (разд. К,2,в), некоторых алкогольдегидрогеназ (гл. 8, разд. 3,2) и супероксид-дисмутазы (дополнение 10-3). Известно, что цинк связывается и с гексамерами инсулина (рис. 4-13,В).
Необычный белок металлотионеин, присутствующий во всех животных тканях, связывает большие количества ионов многих металлов и в особенности Zn2+. Этот небольшой по размерам белок с мол. весом ~6600 содержит 33% цистеина и связывает целых шесть ионов металла на молекулу белкад. Роль металлотионеина неизвестна. Возможно, он выполняет роль буфера для ионов металлов или служит для удаления нежелательных металлов. В своей свободной форме он мог бы выступать в роли окислительно-восстановительного буфера, подобно глутатиону (дополнение 7-Ж).
У многих плотоядных животных отражающий слой за сетчаткой глаза, тапетум, содержит кристаллы Zn2+-цистеинового комплекса. Поскольку ионы цинка бесцветны, их присутствие во многих случаях осталось незамеченным. Нет сомнения, что ионы цинка будут найдены еще в клетках многих других тканей.
Ионы цинка в ферментах часто могут быть заменены ионами Мn2+, Со2+ и другими ионами без существенного снижения каталитической активностив,д,е. С точки зрения проблем, возникающих в связи с питанием, следует иметь в виду, что с цинком конкурируют Сu2+ и очень токсичный Cd2+. Последний накапливается в корковом веществе почек. Скармливание крысам и мышам пищи, содержащей кадмий в концентрациях ниже тех, которые обнаружены в почках человека, приводит к сокращению продолжительности жизни.
а O’Dell В. L., Campbell В. J. (1971). Comp. Biochem, 21, 179—216.
б Liljas A., Rossman М. G. (1974). Annu. Rev. Biochem, 43, 475—507.
в Mildvan A. S., (1974). Annu. Rev. Biochem., 43, 357—399.
г Polesz B. J., Seal G., Loeb L. A. (1974). Proc. Nat. Acad. Sсi. USA, 71, 4892—4896.
д Kägi J. H. R., Himmelhoch S. R., Whangler P. D., Bethune J. L, Vatlee B. L. (1974). J. Biol. Chem., 249, 3537—3542.
e Bigbee W. L., Dahlquist F. W. (1974). Biochemistry, 13, 3542—3549.