Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции присоединения и элиминирования
Имины
Многие ферментативные реакции связаны с образованием иминов (шиффовых оснований). Реакция протекает в две стадии — присоединение аминогруппы к карбонильной группе с образованием карбинол- амина и последующее отщепление воды:
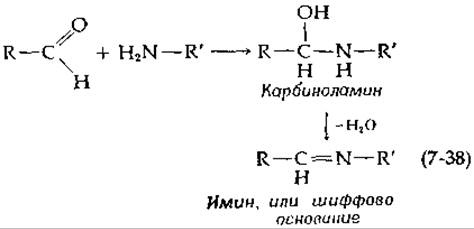
Многие альдолазы (разд. К,2) содержат в активном центре боковые группы лизина. Аминогруппы этих боковых цепей образуют шиффовы основания с кетонными субстратами. Эти реакции предшествуют основным реакциям расщепления и образования связей С—С. Начальная реакция взаимодействия кофермента пиридоксальфосфата с аминокислотными субстратами состоит в образовании шиффовых оснований (гл. 8, разд. Д). Действительно, группам присуща комплементарность, и их взаимодействие с промежуточным образованием имина — очень распространенная биохимическая реакция.
![]()
Шиффовы основания образуются быстро (часто в течение долей секунды), но не мгновенно, и для достижения скоростей, характерных для ферментативных реакций, необходимо, чтобы одна или обе стадии реакции (7-38) протекали с участием катализаторов [105]. Обычно эта реакция полностью обратима, и константы образования шиффовых оснований часто бывают низкими. Поэтому карбонильное соединение, присутствующее в малых количествах, может полностью не прореагировать с амином, если карбонильная группа и аминогруппа не приведены в контакт на поверхности фермента.
Большинство шиффовых оснований может быть легко восстановлено боргидридом натрия (NaBH4) с образованием вторичных аминов, в которых исходные альдегиды оказываются ковалентно связанными с исходными аминогруппами:
![]()
Эта реакция лежит в основе широко используемого метода обнаружения шиффовых оснований в белках и введения изотопных меток. Например, можно использовать меченный изотопом альдегид или амин либо ввести радиоактивную метку, используя 3Н-содержащий боргидрид натрия (так называемый бортритид) для восстановления в реакции (7-39). Последующий гидролиз белка (кислотный или ферментативный) позволяет установить, с боковой группой какой аминокислоты был связан субстрат, а частичный гидролиз позволяет локализовать центр связывания в пептидной цепи.