Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Енольные промежуточные соединения в реакциях изомеризации
Другие изомеразы фосфатов сахаров
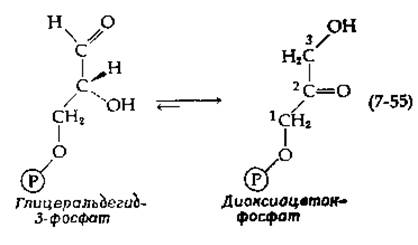
Фермент маннозо-6-фосфат—изомераза, катализирующая превращение маннозо-6-фосфата в фруктозо-6-фосфат, представляет собой Zn2+- содержащий мономерный белок с мол. весом ~ 45 000. Димерная триозофосфатизомераза (с мол. весом ≈52 000) катализирует взаимопревращение глицеральдегид- и диоксиацетонфосфатов и считается самым активным из ферментов, принимающих участие в гликолизе (разд. А,5). Его молекулярная активность равна ~ 2800 с-1 для реакции, направленной в уравнении (7-55) вправо, и 250 с-1 для обратной реакции (преобладающее направление в метаболизме). Несмотря на то что высокая каталитическая активность этого фермента может облегчать внутримолекулярный перенос протона, отщепляемого ферментом, такой перенос наблюдался редко. Это свидетельствует о том, что относительно слабое основание, такое, как карбоксилат-ион, может служить акцептором протона в положении С-3 диоксиацетонфосфата [135]. Различные эксперименты с ковалентно привязанными метками также указывают на участие карбоксильной группы, принадлежащей остатку Glu-165 [130].
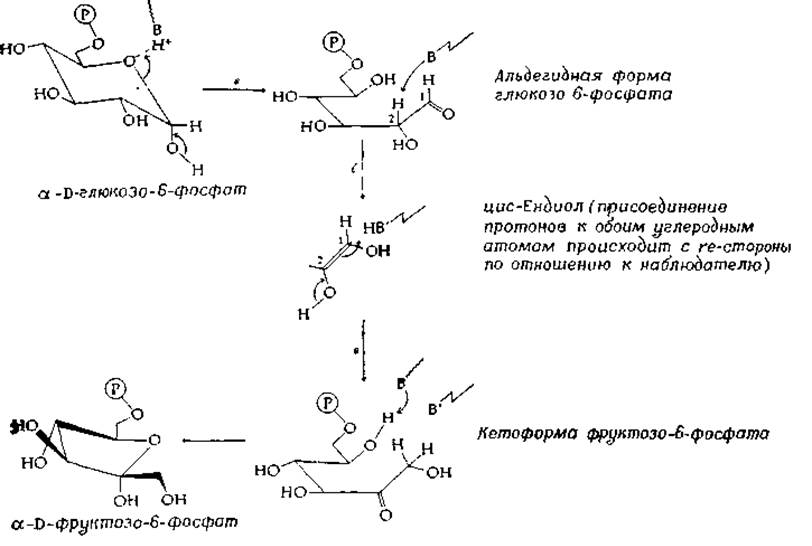
РИС. 7-9. Реакции раскрытия цикла и изомеризации, катализируемые глюкозо-6-фосфат—изомеразой (по Нолтману [130]).
Недавно методом рентгеноструктурного анализа была определена структура триозофосфатизомеразы из мышц цыпленка [136]. Около 22% из 247 аминокислотных остатков каждого мономера образуют восьмицепочечные параллельно упакованные участки ß-структур. Они скручиваются, образуя структуру, имеющую форму цилиндра (гл. 2, разд. Б,4). ß-Структуры чередуются с четырьмя а-спиральными участками, включающими 55% всех аминокислотных остатков. Структура этого фермента несколько напоминает структуру глицеральдегидфосфатдегидрогеназы (рис. 2-10).
Другой важной изомеразой является фермент, осуществляющий взаимопревращение рибозо-5-фосфата и рибулозо-5-фосфата.