Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Енольные промежуточные соединения в реакциях изомеризации
∆5-3-кетостероид - изомераза и другие ферменты, катализирующие 1,3-миграцию протона
В организме животных холестерин служит предшественником всех стероидных гормонов, в том числе таких 3-кетостероидов, как прогестерон и тестостерон (гл. 12, разд. И,3). В то время как холестерин содержит двойную связь в 5,6-положении — как в соединении, показанном в уравнении (7-56) слева, — в кетостероидах двойная связь сопряжена с карбонильной группой. Вначале гидроксильная группа холестерина окисляется в кетогруппу (стадия а). Вслед за этим происходит практически необратимая миграция двойной связи, катализируемая ∆5-3-кетостероид—изомеразой (стадия б) [137]. Этот фермент был получен в полностью очищенном виде из Pseudomonas testosteroni. Он представляет собой олигомерный белок с мол. весом ~40 000, имеет исключительно высокую молекулярную активность (~105c-1), обусловленную главным образом необычайно низким значением ∆Н≠. Белок очень гидрофобен и растворим в среде, содержащей высокие концентрации этанола. В случае фермента животного происхождения - это свойство указывает на то, что фермент локализован в эндоплазматическом ретикулуме.

Субстраты, содержащие 2Н в 4-положении, реагируют со скоростью, составляющей всего лишь четвертую часть от скорости превращения нормальных субстратов. Большой изотопный эффект указывает на то, что расщепление связи С—Н, приводящее к образованию енолят-аниона (по-видимому, стабилизированного ферментом), является лимитирующей стадией (стадия а на приведенной ниже схеме):

Протон, находящийся в аксиальном положении при С-4, отщепляется [138] и должен переноситься какой-то группой молекулы фермента в положение 6, откуда он возвращается к субстрату, вновь в аксиальное положение (стадия б), что свидетельствует о син-переносе. В процессе этой реакции не наблюдается обмена протонов с растворителем, по-видимому, из-за чрезвычайно высокой скорости действия изомеразы. О том, что в реакции действительно имеет место перенос Н+, а не какой-то другой механизм, говорит следующий факт: в плохих субстратах и конкурентных ингибиторах, таких, как нортестостерон [который содержит двойную связь в том же положении, что и продукт реакции (7-57)], происходит полный обмен одного из атомов водорода при С-4 со средой. Кроме того, УФ-спектр поглощения для ингибитора в результате взаимодействия с ферментом сдвигается от 248 к 258 нм. Этот факт позволяет сделать предположение об образовании стабилизированного енолят-аниона, изображенного на схеме (7-57).
Катализируемая ферментом изомеризация цис-аконитата в транс-аконитат [уравнение (7-58)] также, по-видимому, включает перенос протона [139]:
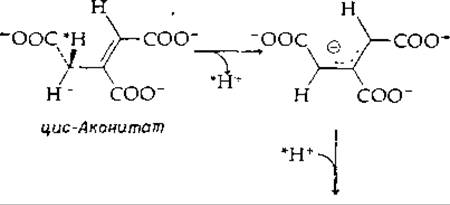

Распространяется ли резонанс в анионе на карбоксильные группы, не ясно, но можно все же думать, что это так и что механизм изомеризации, вероятно, сходен с механизмом реакции, катализируемой кетостероид-изомеразой. Однако существуют другие аллильные перегруппировки, когда субстратами реакции служат соединения, не содержащие ни карбонильной, ни карбоксильной групп. Неизвестно, протекают ли эти перегруппировки с промежуточным образованием аниона или карбоний-иона.
Аллильные перегруппировки, включающие переносы протона, могут также служить составной частью механизма других типов реакций, катализируемых ферментами.