Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Спеціальна частина
Фенольні сполуки
Флавоноїди
Флавоноїди — це біологічно активні речовини, в основі яких лежить дифенілпропановий фрагмент, із загальною формулою С6—С3—С6.
Назва походить від латинського слова flavus — жовтий, тому що перші виділені флавоноїди мали жовте забарвлення.
Будова та класифікація
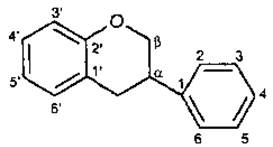
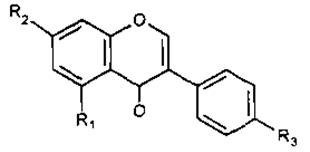
Будова. Молекула флавоноїда складається з двох фенольних залишків (кільця А і В), з’єднаних пропановою ланкою, тому їх можна розглядати як похідні фенілпропаноїдів.
![]()
Флавоноїди мають різне положення фенольних радикалів у пропановому фрагменті. За цією ознакою їх поділяють на три основні групи: еуфлавоноїди, ізофлавоноїди та неофлавоноїди.
І група — еуфлавоноїди, або власне флавоноїди, або справжні флавоноїди, в яких кільце В приєднане по С-3 положенню пропанового ланцюга.

Якщо з кільцем А конденсується гетероцикл пірану, то утворюється флаван (фенілбензопіран). Окислений флаван має у складі молекули у-пірон.
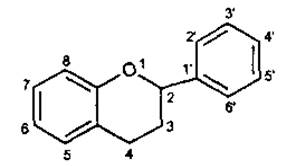
Флаван
(2-феніпхроман, 2-фенілбензопіран)
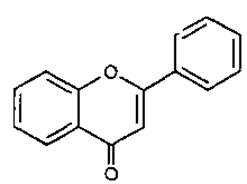
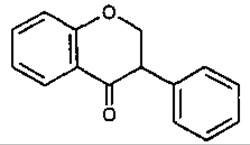
Флавон
(2-фенілхромон, 2-фенілбензо-у-пірон)
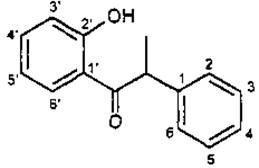
II група — ізофлавоноіди, кільце В приєднане до другого вуглецевого атома пропанового фрагмента.
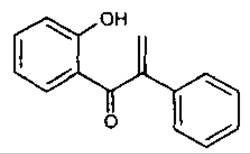
III група — неофлавоноїди, містять кільце В по С-1 положенню пропанового ланцюга.
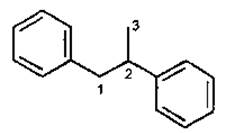
Ізофлавоноїди
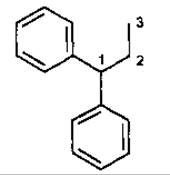
Неофлавоноіди
Класифікація еуфлавоноїдів. За ступенем окислення пропанового фрагмента та величиною гетероциклу еуфлавоноіди можна розділити на 10 класів.
Похідні флавану
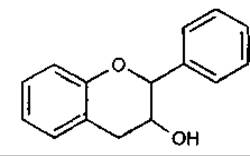
1 Флаван-З-ол (катехін)

2. Флаван-3,4-діол (лейкоантоціанідин)
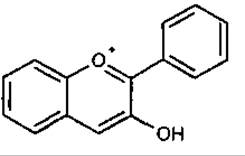
З Антоціанідин
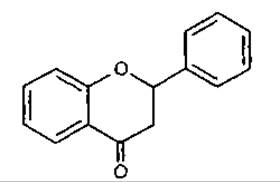
4 Флаванон
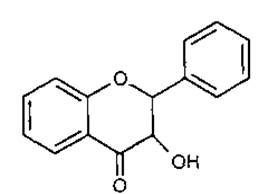
5 Флаванонол
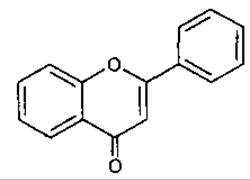
6. Флавон

7 Флавонол
Клас ауронів, які мають п’ятичленний гетероцикл, можна розглядати як похідні 2-бензиліденкумарона.
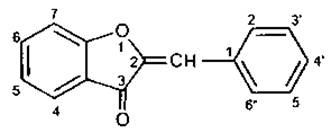
8. Аурон
Флавоноїди з відкритим пропановим фрагментом називаються халкони та дигідрохалкони.
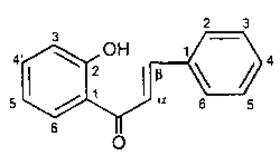
9. Халкон
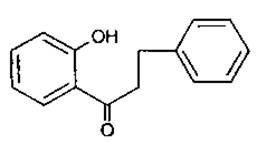
10 Дигідрохалкон
Флавоноїди можуть конденсуватися між собою і з іншими фенольними сполуками: фенолкарбоновими і оксикоричними кислотами, лігнанами, а також з ізопреноідами, алкалоїдами та ін.
Поряд з мономірними флавоноїдами описані природні димери (біфлавоноїди), олігомери, що побудовані з залишків лейкоантоціанів або антоціанів, та полімери (конденсовані таніни).
Класифікація ізофлавоноїдів. В основі класифікації ізофлавоноїдів лежить ступінь окислення пропанового фрагмента і характер гетероциклу. Ізофлавоноїди поділяють на прості й конденсовані. До простих ізофлавоноїдів належать ізофлавани, ізофлаванони, ізофлавони, ізохалкони; до конденсованих — куместани, птерокарпани, ротеноїди тощо.
Прості ізофлавоноїди
Ізофлаван
Ізофлаванон

Ізофлавон
Ізодигідрохалкон
Ізохалкон
Конденсовані ізофлавоноїди

Куместан, або кумаранокумарин
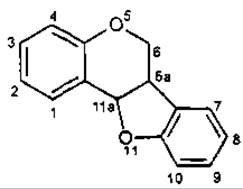
Птерокарпан, або кумаранохроман
Ротенон, або хроманохроманон
Класифікація неофлавоноїдів. Серед неофлавоноїдів зустрічаються підкласи флавану, флавону, халкону. Внаслідок заміщення С-4 положення замість у-пірону в групі трапляються сполуки з а-піроновим гетероциклом.
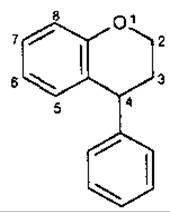
Неофлаван

Неофлавон

Неохалкон
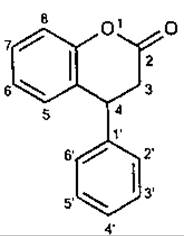
4-Фенілбензо-а-пірон (4-фенілкумарин)
Найбільш поширені флавоноїди
Ізомери катехіну
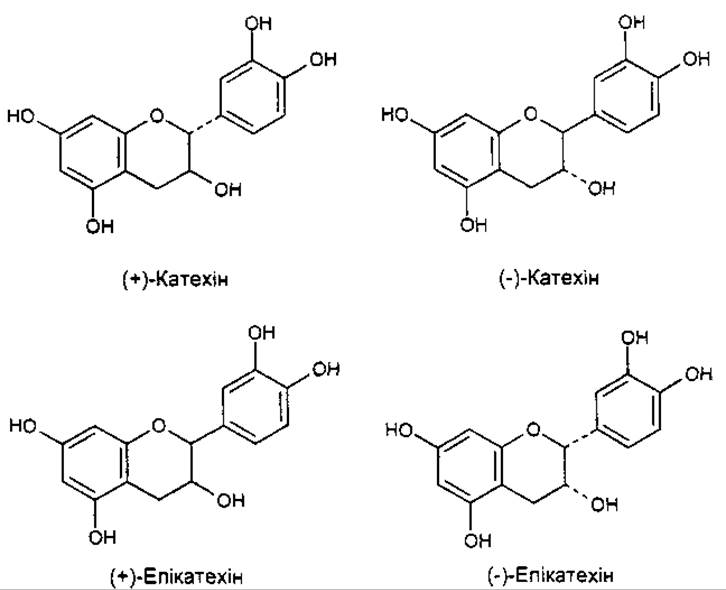
У табл. 5-10 наведено найпоширеніші флавоноїди.
Таблиця 5
Антоціанідини
Назва |
R1 |
R2 |
Пеларгонідин |
Н |
Н |
Ціанідин |
ОН |
Р |
Дельфінідин |
ОН |
ОН |

Таблиця 6
Флаванони
Назва |
R1 |
R2 |
R3 |
Ліквіритигенін |
Н |
ОН |
Н |
Нарінгенін |
Н |
ОН |
ОН |
Бріодикпол |
ОН |
ОН |
ОН |
Геспередин |
ОН |
ОСН3 |
ОН |

Таблиця 7
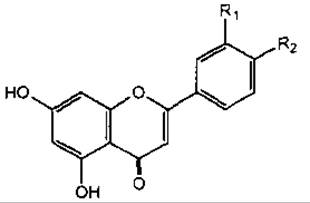
Флавони
Назва |
R1 |
R2 |
Апігенін |
Н |
ОН |
Лютеолін |
ОЕ |
ОН |
Акацетин |
Н |
ОСН3 |
Діосметин |
ОН |
ОСН3 |
Таблиця 8
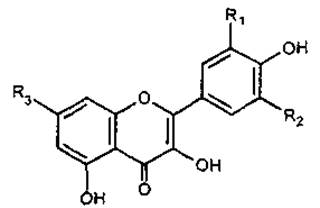
Флавоноли
Назва |
R1 |
R2 |
R3 |
Кемпферол |
Н |
Н |
ОН |
Кверцетин |
ОН |
Н |
ОН |
Мірицетин |
ОН |
ОН |
ОН |
Рамнетин |
ОН |
Н |
ОСН3 |
Ізорамнетин |
ОСН3 |
Н |
ОН |
Таблиця 9
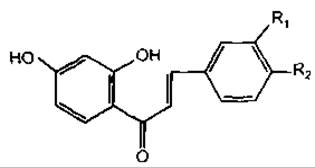
Халкони
Назва |
R1 |
R2 |
Бутeiн |
ОН |
Н |
Ізоліквіритигенін |
Н |
ОН |
Таблиця 10
Ізофлавони
Назва |
R1 |
R2 |
R3 |
Пеністеін |
ОН |
ОН |
ОН |
Формононетин |
Н |
ОН |
ОСН3 |
Ізоформононетин |
Н |
ОСН3 |
ОН |
Характеристика флавоноїдних глікозидів
Флавоноїди рідко зустрічаються у вигляді агліконів. Більшість флавоноїдів представлені глікозидами. Перевага заміщення будь-якого положення залежить від структури аглікону. Так, наприклад, у флавонів заміщення відбувається в положенні С-7, рідше — в С-3ґ, С-4ґ, у С-глікозидів — в С-6, С-8 У флавонолів звичайно замісники приєднані в положенні С-3 або С-7.
Залишки сахарів представлені D-глюкозою, D-галактозою, D-ксилозою, L-рамнозою, L-арабінозою, D-глюкуроновою кислотою, рідко D-ra-лактуроновою кислотою.
Здебільшого у флавоноїдних глікозидах вуглеводний залишок зв’язаний з агліконом напівацетальним зв’язком через атом кисню О-глікозиди, в залежності від кількості і положення сахарних залишків, можуть бути монозидами, біозидами, диглікозидами, тріозидами, а вуглеводна частина — лінійною або розгалуженою.
Сахар може бути приєднаний до аглікону С-зв’язком, утворюючи С-глікозиди, або глікофлавоноіди. Найчастіше вуглевод заміщує С-6, С-8 або С-6 і С-8 У С-глікозидах зустрічаються D-глюкоза, рідше D-галактоза, D-ксилоза, L-рамноза і L-арабіноза.
Біосинтез
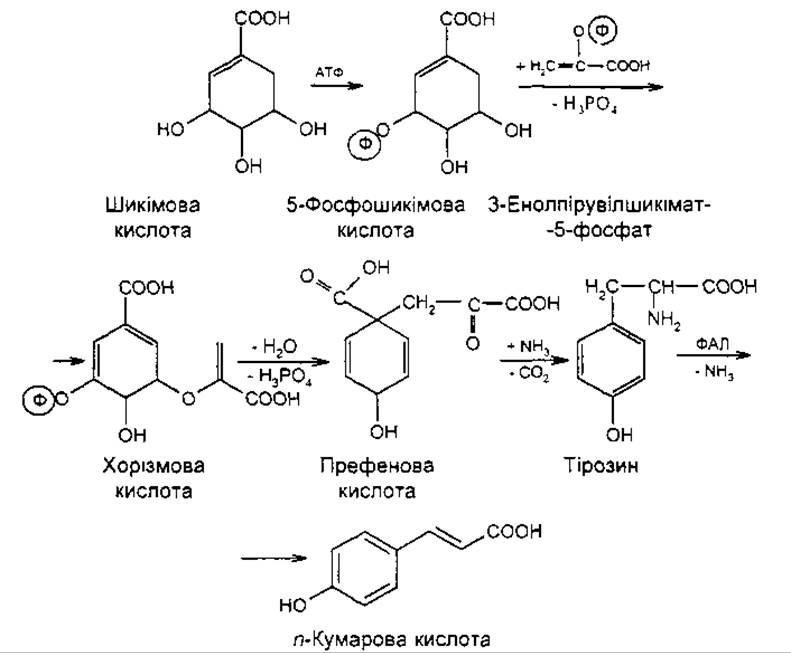
Біосинтез флавоноїдів перебігає змішаним шляхом. Кільце А і пропановий фрагмент утворюються ацетатним шляхом, кільце В — через шикімову кислоту.
Утворення кільця В. Шикімова кислота за участю АТФ фосфорилюється в 5-фосфошикімову кислоту, яка з’єднується з фосфоенолпіровиноградною кислотою, утворює 3-енолпірувілшикімат-5-фосфат, а потім хорізмову кислоту. Остання перегруповується в префенову кислоту, яка є проміжною сполукою в біосинтезі ароматичних амінокислот, флавоноїдів, кумаринів та інших поліфенолів. Префенова кислота амінується і декарбоксилюється, в результаті чого може утворитися фенілаланін або тірозин. Дезамінування амінокислот призводить до появи коричної або n-кумарової кислоти.
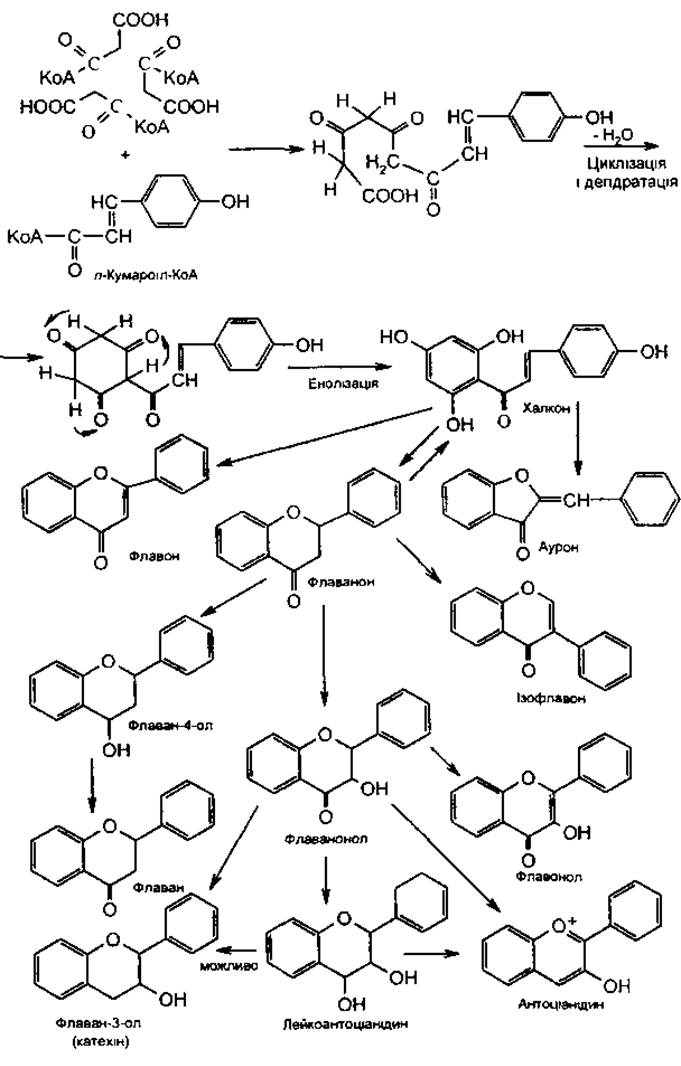
Утворення кільця А і флавоноїдів. Кільце А утворюється з трьох молекул оцтової або малонової кислоти за участю КоА-ферменту. Продукт циклізації, який при цьому утворюється, реагує з n-кумаровою кислотою (n-кумароіл-КоА). В результаті їх конденсації, циклізації та енолізаци утворюється халкон (схема).
При окисленні халкону утворюються флавони, флавоноли та інші, а при відновленні — антоціанідини, лейкоантоціанідини та катехіни.
Утворення кільця В флавоноїдів
Поширення, локалізація та біологічні функції у рослинах
Флавоноїди містяться мало не в усіх рослинах, зустрічаються у мікроорганізмах та у комах.
Найбагатші на флавоноїди родини Fabaceae, Polygonaceae, Asteraceae, Rosaceae. Накопичуються вони здебільшого в квітках, листках, менше — в стеблах, кореневищах, коренях. Вміст їх коливається від 0,1 до 20 % (наприклад, в пуп’янках софори японської) і змінюється залежно від фази вегетації рослини. Максимальна кількість флавоноїдів спостерігається під час цвітіння, потім їх стає менше. Неабияке значення мають зовнішні фактори: рослини тропічні та високогірні містять більше флавоноїдів; тому вважається, що кількість їх залежить від інтенсивності сонячного світла та висоти над рівнем моря.
Глікозиди звичайно містяться в тканинах активного росту (листках, пуп’янках, квітках), аглікони — у здерев'янілих тканинах (кора, корка).
Загальна схема біосинтезу флавоноїдів
Флавоноли становлять 40 % від усіх флавоноїдів. Рутин, наприклад, виявлений більш як у 70 видах, які відносяться до 34 родин, кверцетин — більш як у 400 видах.
Антоціанідини впливають на колір квіток, плодів, а також листя. У природі відомо 22 аглікони антоціанідинів, але дуже поширені лише три з них. пеларгонідин, дельфінідин, ціанідин. Наприклад, ціанідин забарвлює яблука, вишні, малину та порічку, дельфінідин — гранат, баклажани, пеларгонідин — суниці, плоди пасифлори, ціанідин з дельфінідином — чорну смородину, апельсини.
Халкони і аурони легко виявити в пелюстках квіток — під дією парів аміаку їх колір змінюється з жовтого на червоний. їхнє поширення обмежене дев’ятьма родинами.
Більшість флавоноїдів розчиняються в клітинному соку рослин і знаходяться в хлоропластах. Халкони і аурони череди трироздільної локалізовані в молочниках; флавоноли і флавони — в епідермісі, ізофлавоноїди — переважно в підземних органах і насінні.
Флавоноїди є типовими рослинними барвниками, що відіграють роль фільтрів і захищають тканини рослини від ультрафіолетового проміння, запобігають руйнуванню хлорофілу. Знайшла підтвердження гіпотеза про участь флавоноїдів у процесах дихання рослин, бо стало відомо, що вони разом з аскорбіновою кислотою витрачаються в ензиматичних процесах окислення та відновлення, виконуючи антиоксидантну функцію. Доведено також, що флавоноїди впливають на ріст і розвиток рослин, беруть участь у процесі запліднення, але механізм їхньої дії тут не з’ясований. Наприклад, рутин здатний пригнічувати запліднення.
Фізико-хімічні властивості
Флавоноїди — кристалічні сполуки з певною температурою топлення. Катехіни, лейкоантоціанідини, флавани, ізофлавани, флаванони, флаваноноли — безбарвні кристали; флавони, флавоноли, халкони, аурони — жовті або жовтогарячі. Антоціани змінюють колір в залежності від pH-середовища в кислому — вони мають відтінки червоного кольору, в лужному — синього.
Аглікони флавоноїдів розчиняються у діетиловому ефірі, ацетоні, спиртах, практично нерозчинні у воді. Глікозиди флавоноїдів звичайно розчиняються у розбавлених спиртах, гарячій воді.
Флаваноли (катехіни) оптично активні. Так, катехін існує в чотирьох ізомерах, які відрізняються напрямком, кутом обертання (D- та L-катехіни, D- та L-епікатехіни) та біологічною дією. Наприклад, L-епікатехін має Р-вітамінну активність у той час, коли інші й не мають.
Флаванони і флаваноноли — лабільні сполуки. Під дією реагентів, які мають окислюючі властивості, вони можуть переходити відповідно в халкони і лейкоантоціанідини.
Флавоноїдні О-глікозиди піддаються кислотному, лужному та ферментному гідролізу Так, при нагріванні 3-О-глікозиди легко гідролізуються мінеральними кислотами з концентрацією 0,1-1 %. Для гідролізу 7-О-глікозидів необхідне нагрівання протягом декількох годин з 5-10 % мінеральними кислотами, але легше проходить у них гідроліз в присутності лугів.
С-зв’язок між агліконом і сахаром дуже міцний, тому гідроліз С-глікозидів проводять реактивом Кіліані (суміш концентрованої хлористоводневої та льодяної оцтової кислот).
Методи виділення та дослідження
Виділення. Найчастіше для виділення флавоноїдів з рослинної сировини використовують нижчі спирти: етанол, метанол. Спиртові витяжки випарюють до водного залишку, розводять водою і оброблюють хлороформом для відокремлення ліпідів та ліпоїдів: хлорофілу, каротиноїдів, восків, жирної олії та ін. Очищений водний залишок послідовно оброблюють діетиловим ефіром, етилацетатом, пропанолом, бутанолом, одержуючи фракції агліконів, монозидів, біозидів, тріозидів відповідно.
Для поділу флавоноїдів на індивідуальні компоненти використовують колонкову хроматографію на силікагелі, поліаміді, целюлозі. Колонку елюють сумішшю хлороформу зі спиртом, поступово збільшуючи долю спирту в суміші.
Якісні реакції. Ціанідинова проба є специфічною реакцією на флавоноїди. Часто її виконують у модифікації Синода. Флавоноїди відновлюються воднем під час виділення його при взаємодії металічного магнію з концентрованою хлористоводневою кислотою, внаслідок цього утворюються забарвлені антоціанідини.
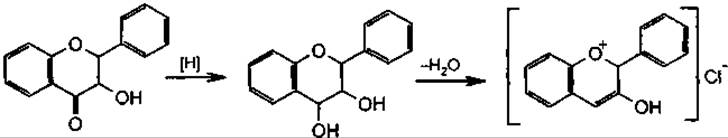
Ізофлавоноіди, флавани дають жовте забарвлення, іноді — червоне. Флавоноли — від малинового до яскраво-червоного.
Халкони та аурони ціанідинової реакції не дають, але з концентрованою хлористоводневою кислотою утворюють червоне забарвлення за рахунок утворення оксонієвих солей. Антоціани також змінюють колір глікозиди дельфінідину дають синьо-червоне забарвлення, ціанідину — яскраво-червоне, а пеларгонідину — жовтогарячо-червоне.
Реакція з борно-лимонним реактивом. 5-Оксифлавони і 5-оксифлавоноли утворюють з борною кислотою в присутності лимонної або щавлевої кислот комплекс яскраво-жовтого кольору з жовто-зеленою флуоресценцією. 3-Оксифлавони без гідроксильного радикалу при С-5 не дають цієї реакції.
Реакція з п'ятихлористою сурмою. Розчин солі в чотирихлористому вуглеці з флавоноїдами утворює червоне або жовтогаряче забарвлення. Це пояснюється тим, що SbCl5 за силою дії подібний до сірчаної кислоти і викликає відповідний галохромізм. Халкони дають червоне, червоно-синє забарвлення; флавони — жовте, жовтогаряче.
Дигідрохалкони, в яких відсутній подвійний зв’язок між карбонільною групою та кільцем В, не дають забарвлення з SbCl5.
Реакція азосполучення. З діазотованим сульфаніламідом флавоноїди, які мають вільну гідроксильну групу в положенні С-7, утворюють забарвлені продукти азосполучення. Флавони, флаванони, флаваноли, флаваноноли дають жовте забарвлення з розчином аміаку. Халкони та аурони мають червоно-пурпурове забарвлення.
Реакція з розчинами лугів. З теоретичної точки зору забарвлення не утворюють з розчинами лугів флавоноїди, які не мають карбонильних груп (катехіни, лейкоантоціани) або у яких відсутній подвійний зв’язок між гідроксильною та карбонільною групами (флаваноноли). Але практично всі ці сполуки утворюють забарвлення з лугами завдяки вторинним перетворенням. Флаванони дають у взаємодії з розбавленими лугами безкольорові або жовтуваті розчини, які з часом стають яскраво-жовтими або червоними внаслідок їх ізомеризації в халкони. Халкони та аурони одразу утворюють з лугами червоні та пурпурові розчини. Ця реакція є для них специфічною, бо жодна інша група флавоноїдів її не дає. Флавони і флавоноли утворюють з лугами жовті, а поліоксифлавоноли (шість та більше груп) — червоні або сині розчини.
Реакція з концентрованою сірчаною кислотою. Багато кристалічних флавоноїдів розчиняються в сірчаній кислоті і утворюють забарвлені розчини. Флавони та флавоноли утворюють при цьому оксонієві (флавілієві) солі.
Флаванони набувають у сірчаній кислоті яскраво-жовтогарячого або червоного забарвлення, що зумовлене появою солей відповідних халконів, які мають сполучені подвійні зв’язки в іонах.
Халкони та аурони з сірчаною кислотою утворюють інтенсивне — від червоного до малинового кольору забарвлення, що пояснюється також появою хіноїдних структур.
Реакція з розчином ваніліну в концентрованій хлористоводневій кислоті. У цьому випадку катехіни дають червоно-малинове забарвлення.
Реакція з середнім ацетатом свинцю. При взаємодії з середнім ацетатом свинцю дають осад флавоноїди, які мають дві ортооксигрупи в кільці В. Колір осаду з флавонами — жовтогарячий, з ауронами — червоний, з антоціанами — червоний або синій.
Хроматографічне виявлення флавоноїдів. Для поділу і виявлення флавоноїдів використовують паперову хроматографію (ПХ) та хроматографію в тонкому шарі сорбенту (ТШХ). В УФ-світлі при довжині хвилі 360 нм більшість флавоноїдів флуоресціюють: флавони, флавонол-3-глікозиди, халкони — темно-брунатним кольором; флавоноли та їх глікозиди — жовтим, жовто-зеленим; птерокарпани — світло-блакитним; куместани — яскраво-блакитним, бірюзовим. Інші класи флавоноїдів не флуоресціюють.
Хроматограми звичайно проявляють хромогенними реактивами, які використовують для якісних кольорових реакцій. Це спиртові розчини лугів, гідрокарбонату натрію, алюмінію хлориду, пари аміаку та ін.
Кількісне визначення. Для кількісного визначення флавоноїдів запропоновано багато методів: вагові, об’ємні (потенціометричне титрування в неводних середовищах, комплексометричне титрування), флуорометричні, полярографічні, фотоколориметричні. Але найбільше значення має спектрофотометричний метод. Він базується на реакціях комплексоутворення з іонами різних металів, реакції азосполучення, з борною кислотою з наступним визначенням оптичної густини в УФ-світлі при відповідній довжині хвилі.
Біологічна дія та застосування
Флавоноїди містять у молекулі реакційно здатні фенольні радикали та карбонільне угрупування. Завдяки цьому вони беруть участь у різноманітних метаболічних процесах, що обумовлює їхню біологічну активність. До важливіших видів фармакологічної дії належать:
Р-вітамінна, тобто біофлавоноїди позитивно впливають на стан капілярних судин: підвищується їхня стійкість, збільшується еластичність та пропускна здатність;
діуретична, яка притаманна як чистим флавоноїдам, так і ЛРС;
кардіотонічна та гіпотензивна активність (наприклад, препарати Crataegus);
спазмолітична (перш за все впливають на гладенькі м’язи кровоносних судин);
антиоксидантна, протирадіаційна.
Флавоноїди діють на травний тракт, печінку, матку, виявляють противиразковий, ранозагоювальний, протипухлинний ефект тощо. Фармакологічна дія флавоноїдів залежить від їхнього класу. Для ізофлавонів характерна естрогенна, для катехінів — в’яжуча та протизапальна дія на слизові оболонки; флавони викликають спазмолітичний, гіпотензивний, бактерицидний ефект. Як спазмолітики діють також халкони, флаванони (ліквіритин), флавоноли (кверцетин, рутин), флавони (апігенін). Помірну протипухлинну дію виявляють лейкоантоціанідини — пеларгонідин, дельфінідин, ціанідин.
Багатьом флавоноїдам, наприклад мірицетину, флавоноїдам цмину піскового, цикорію, череди, притаманна жовчогінна дія.
Флавоноїди утворюють хелатні комплекси з металами, виявляють радіопротекторну дію, зв’язують і виводять радіонукліди.
Останнім часом встановлені гіпоглікемічна та анаболізуюча дія флавоноїдів.
Усі природні флавоноїди малотоксичні, при широкому спектрі біологічної дії, що робить їх привабливими для створення нових фітопрепарагів.
Р-вітамінна дія. Під назвою «вітамін Р» об’єднані фенольні сполуки, які здатні зменшувати проникність і ламкість капілярів, підвищувати їх резистентність. Це флавони гесперидин, еріодиктин; флавоноли рутин, кверцитрин, ізокверцетин, кверцетин, ізорамнетин; метилхалкон; L-епікатехін; оксикумарини ескулін, ескулетин.
Механізм їхньої дії пояснюється тим, що сполуки з Р-вітамінною активністю знижують рівень гіалуронідази, запобігають окисленню аскорбінової кислоти і адреналіну, який підвищує міцність кровоносних судин. Надлишок гіалуронідази збільшує проникність капілярів і викликає крововилив під шкіру, що є ознакою Р-авітамінозу.
Поліфеноли і аскорбінова кислота доповнюють та потенціюють взаємну дію на капіляри, тому у лікарських формах часто містяться разом (аскорутин). Крім того, вони завжди поєднані в ягодах, плодах, овочах.
Дія на серцево-судинну систему. Похідні флавонолів, катехінів і антоціанів (рутин, кверцетин, кверцитрин, лейкоантоціанідини, комплекс катехінів чаю, мірицетин, пеларгонідин та ін.) збільшують амплітуду серцевих скорочень, нормалізують серцевий ритм.
Флавоноїди посилюють серцеві скорочення, прискорюють мікроциркуляцію крові, внаслідок чого покращується живлення серцевого м’яза і виникає позитивний інотропний ефект. Деякі флавоноїди (гіперозид, С-глікозид вітексин, кверцетин, кемпферол, сума поліфенолів з квіток глоду) розширюють судини, у тому числі й коронарні. Впливають флавоноїди й на швидкість ензиматичних процесів та активність циклооксигенази, ліпооксигенази, аденозиндеамінази, які впливають на окислення ліпідів, нейропередачу, згортання крові. Але більшість таких взаємодій ще не з’ясована.
Флавоноїди можуть викликати короткочасне підвищення артеріального тиску, але більшість публікацій присвячена вивченню гіпотензивної активності флавоноїдів солодки, щавлю, ранника, катехінів чаю та виділених агліконів і глікозидів. Поліфеноли стимулюють (у великих дозах пригнічують) діяльність серця і знижують на короткий час артеріальний тиск внаслідок розширення судин черевної порожнини. Але є свідчення й про місцеву, безпосередню дію на мускулатуру серця і судин.
Вплив на функцію нирок. Значна кількість рослин містить флавоноїдні сполуки з діуретичною активністю — трава різних видів гірчака, трава остудника голого, парила, солодки, звіробою, якірців сланких, плоди шипшини та багато інших. Флавон лютеолін викликає тривале Підвищення діурезу; катехіни, навпаки, знижують сечовиділення.
Заслуговує на увагу гіпоазотемічна активність деяких флавоноїдів, наприклад, робініна, який містять квітки робінії та види астрагалу. Така ж дія виявлена в інших похідних кемпферолу (біоробін, діоробін), у гіперозида, агліконом якого є кверцетин. Препарат леспенефрил, що виробляють з трави леспедеци, містить глікозиди кемпферолу. Ці сполуки сприяють зниженню концентрації азоту у сечі.
Засоби рослинного походження, що містять флавоноїди, застосовують при геморагічних діатезах (схильність до крововиливів), капіляротоксикозах, авітамінозах С і Р, проти інфекційних та токсичних збудників, при хронічних гепатитах, гіпертонії, шкірних хворобах, деяких запальних процесах та ін. Як субстанція, що виділена з рослинної сировини, використовуються рутин, кверцетин. Вони входять до складу лікарських засобів, а найчастіше їх призначають для профілактики склерозу кровоносних судин.
Відомості про основні препарати з рослинної сировини, яка містить флавоноїди, наведено в табл. 7 Додатків.