Принципы структурной организации белков - Г. Шульц 1982
Структурные основы механизма, действия и функции белков
Ферментативный катализ
Каталитический механизм химотрипсина
Каталитический механизм химотрипсина — фермента, расщепляющего пептидные связи, изучен более подробно, чем механизм любого другого фермента [537]. Такие исследования упрощаются благодаря некоторым особенностям химотрипсина. Это мономерный фермент, не проявляющий аллостерических эффектов; структурные изменения, сопровождающие процесс расщепления пептидной связи, очень малы и, наконец, химотрипсин обладает способностью переносить ацильные группы самых разнообразных доноров, например пептидов и эфиров, к самым разнообразным акцепторам, например к воде, спиртам или аминам. Возможность сопоставлений процессов для различных доноров и для различных акцепторов значительно облегчают анализ отдельных каталитических стадий [733, 734].
На основе рентгеноструктурных, спектроскопических и химических данных (см. обзор в [537]) предложен возможный механизм действия химотрипсина (рис. 11.1). После того как фермент и субстрат образовали комплекс Михаэлиса (разд. 10.2), атом кислорода гидроксильной группы остатка Ser-195 атакует карбонильный атом углерода расщепляемой связи субстрата. Образуется неустойчивый тетраэдрический промежуточный продукт [735]. Эта реакция облегчается системой передачи заряда [628, 736], которая осуществляет передачу протона от гидроксильной группы остатка Ser-195, превращая его тем самым в сильный нуклеофил. Затем His-57 подает протон атому азота расщепляемой пептидной связи, в результате чего связь расщепляется. На этой стадии аминная часть образует водородную связь с остатком His-57, тогда как ацильная группа присоединяется к Ser-195 с образованием эфирной связи. На этом завершается стадия ацилирования гидролитической реакции.
Вторая половина процесса — это деацилирование. Аминная часть субстрата удаляется и ее место в активном центре занимает молекула воды. В принципе деацилирование есть процесс, обратный ацилированию, при котором Н2O замещает аминную компоненту [85]. Вначале зарядно-релейная система отрывает протон от воды, образующийся ион ОН- одновременно атакует карбонильный атом ацильной группы, присоединенной к Ser-195. Образуется неустойчивый тетраэдрический аддукт, в котором His-57 подает протон атому кислорода остатка Ser-195, что приводит к освобождению кислотного компонента субстрата, который удаляется диффузией. Теперь фермент готов для следующего каталитического цикла.
Химотрипсин, глицеральдегид-3-фосфатдегидрогеназа и папаин используют аналогичные механизмы реакции. Описанный выше механизм характерен не только для филогенетических родственников химотрипсина, например трипсина или тромбина, но используется также и в других группах белков. Так, например, была отмечена постадийная аналогия реакций, катализируемых такими разными ферментами, как химотрипсин, папаин и глицеральдегид-3-фосфатдегидрогеназа [737] (рис. 11.1).
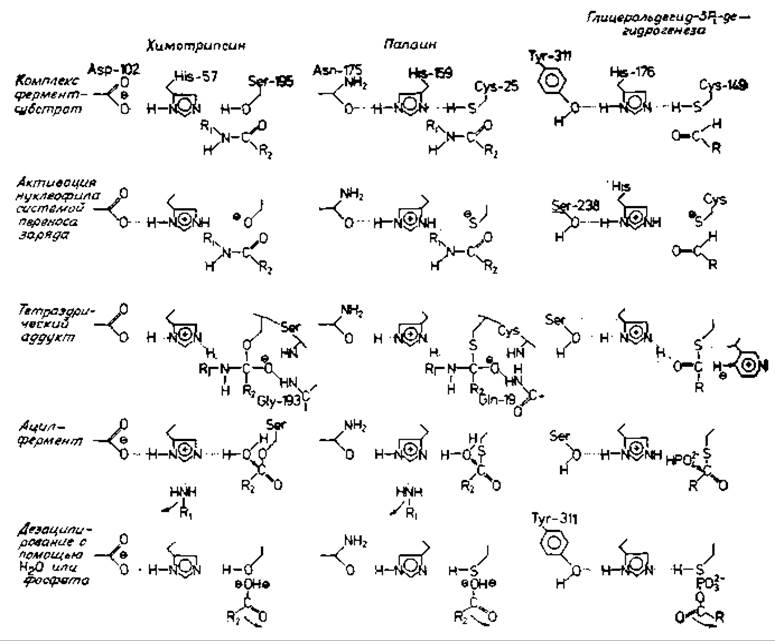
Рис. 11.1. Аналогия механизмов катализа химотрнпсина, папаина и глнцеральдегид-3-фосфатдегидрогеназы [737].
В первом столбце указаны отдельные стадии, характерные для трех ферментов. Тетраэдрические промежуточные продукты (тетраэдрические аддукты), по-видимому, представляют переходные состояния. Приведена система переноса заряда химотрипсина Asp-His-Ser (слева). У субстрата показана только расщепляющаяся пептидная связь R1—NH—СО—R2. Пептидная цепь идет справа налево, как обычно на схемах механизмов протеаз. Все стадии реакции, катализируемой химотрипсином, обсуждаются в тексте; второй упомянутый там тетраэдрический промежуточный продукт показан на рисунке только в начальной фазе: Н2О атакует ацильный промежуточный продукт. Папаин — так называемая сульфгидрильная протеаза; нуклеофильной группой, аналогичной ОН-группе остатка Ser-195 химотрипсина, в папаине служит группа SH. Фермент, приведенный в четвертой колонке, катализирует реакцию: глицеральдегид-3-фосфат + NAD + неорганический фосфат ⇄ 1,3-дифосфоглнцерат + NADH (в качестве субстратов показаны О = CHR, инкотинамидный цикл и НРО2-4). В этом случае процесс, ведущий от тетраэдрического аддукта к ацилферменту, представляет собой реакцию элиминирования гидрид-ионов, т. е. стадию окисления. Ацильный промежуточный продукт атакуется не молекулой Н2О, как в обеих протеазах, а неорганическим фосфатом, так что конечным продуктом реакции является ангидрид кислоты.