Принципы структурной организации белков - Г. Шульц 1982
Структурные основы механизма, действия и функции белков
Ферментативный катализ
Теория переходного состояния
На каждой стадии химической реакции реагирующие вещества переходят из одного относительно стабильного состояния в другое через состояние с более высокой энергией (рис. 11.2). Переходное состояние — это состояние с более высокой свободной энергией, через которое реагирующие вещества должны пройти, чтобы перейти из одного стабильного состояния в другое [738—740]. Для достижения переходного состояния нужна дополнительная свободная энергия ΔG≠ — свободная энергия активации. Согласно уравнению Аррениуса k = s ∙ ехр(—ΔG≠/RT) = s ∙ ехр(—ΔH≠/RT + TΔS/RT) скорость химической реакции зависит от энергии активации [697].
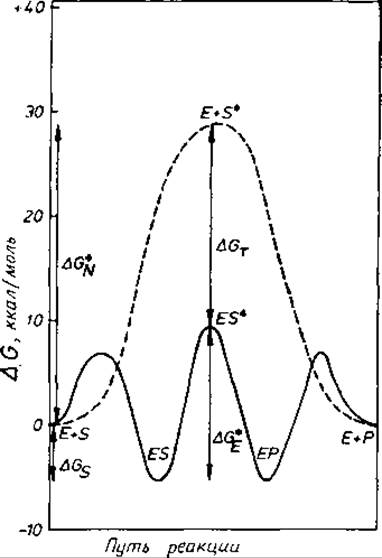
Рис. 11.2. Теория переходного состояния и ферментативный катализ [740]. Показаны профили свободной энергии некатализируемой реакции (пунктирная линия) и соответствующей реакции, катализируемой ферментом (сплошная линия). Учитывается только одно соединение (субстрат); рассматриваемая реакция может быть, в частности, реакцией изомеризации. Предполагается, что и катализируемая, и некатализируемая реакции следуют одному и тому же механизму. Использованы следующие обозначения:
Е — фермент, S — субстрат, Р — продукт, — переходное состояние субстрата. Изменения свободной энергии относятся к следующим реакциям: ΔGS — образование ES из Е и S; ΔGт —образование ES≠ из Е и — образование S≠ из S; ΔG≠E — образование ES≠ из ES. Величины, принятые для расчета изменений свободной энергии: KS — константа ассоциации ES, 104 М-1; КР — константа ассоциации ЕР, 104 М-1; kd— константа скорости первого порядка для диссоциации ES в Е и S и ЕР в Е и Р, 104 с-1; kE— константа скорости реакции первого порядка превращения ES в ЕР, 102 с-1; kN — константа скорости первого порядка соответствующей некатализируемой реакции, 10-5 ∙ с-1; концентрации S и Р приняты равными 1 М; константа равновесия при образовании Р из S равна 1,0.
Энергия активации имеет энтропийную составляющую, отражающую дополнительную упорядоченность, которую должна приобрести система, чтобы достигнуть переходного состояния, например, в том случае, когда атомам для взаимодействия нужно существенно сблизиться. Другая, энтальпийная часть энергии активации представляет работу, которую следует затратить для сближения атомов, достаточного для образования ковалентной связи между ними. Ферменты могут понижать энтальпию активации (по сравнению с реакциями в растворе) в результате специфической фиксации субстратов, выбирая тем самым выгодный путь реакции из тех нескольких путей, по которым следует реакция в растворе.