Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Структурные домены
Симметрия
В пределах одной полипептидной цепи часто встречаются повторяющиеся структурные единицы. Повторяющиеся структурные единицы существуют во многих белках. Такой единицей может быть домен, сверхвторичная структура или какой-либо другой структурный элемент. Примеры таких структур приведены в табл. 5.3. В некоторых белках повторяющиеся единицы расположены друг относительно друга несимметрично, как, например, домены Ser-протеазы (рис. 5.17, г) или кофактор, — связывающие домены глутатионредуктазы [124]. Обращает на себя внимание, однако, то обстоятельство, что часто повторяющиеся единицы имеют приблизительно симметричное расположение; это дает основание полагать, что симметрия является характерным признаком образуемой ими структуры.
Для большого числа идентичных единиц состоянием с наименьшей свободной энергией является кристалл. Предпочтительность симметрии в белках можно уяснить, рассматривая кристаллы, симметрия которых является следствием выгодной упаковки. Упаковка зависит от формы повторяющихся единиц и от профиля их поверхности. Поскольку среди всех возможных схем упаковки имеется одна энергетически наиболее выгодная, она будет отвечать минимальной свободной энергии, в случае если она адекватна для всех звеньев. В любом случае это состояние соответствует кристаллу, принадлежащему к одной из 65 пространственных групп симметрии, допустимых для асимметрических элементов, поскольку кристаллизация остается единственным способом агрегирования бесконечного числа единиц, при котором все образующиеся контакты идентичны.
Для небольшого числа ассоциированных единиц энергетически выгодна симметрия точечной группы. При построении структуры ограниченной величины используется аналогичный принцип. Среди всех контактов между идентичными единицами имеется один, энергетически наиболее выгодный. Если реализуется только этот контакт, то образуется спираль, т. е. линейная группа неограниченного размера. Ее размеры окажутся ограниченными, если на первом витке возникнут стерические затруднения (рис. 5.16, б). Однако в этом случае последний контакт, а значит и вся структура, энергетически невыгодны*. Энергетический оптимум достигается тогда, когда цикл строго замкнут, т. е. если выдерживается симметрия. Поэтому симметричные образования предпочтительны также для агрегатов ограниченной величины. Приведенный аргумент проиллюстрирован на рис. 5.16, б для точечной группы п, т. е. для симметричного расположения вокруг точки с n-й поворотной осью в качестве оператора симметрии. Этот случай можно обобщить для всех точечных групп, образованных симметричными элементами: п, п2, 23, 432, 532 [251, 252]; некоторые из них показаны на рис. 5.16, а.
Таблица 5.3 Повторяющиеся структурные элементы глобулярных белкова
|
Белок |
Повторяющаяся структура |
Число повторяющихся структур |
Приближенная симметрия |
|
Химотрипсин эластаза трипсин |
Полость, образованная шестицепочечной антипараллельной ß-структурой |
2 |
Отсутствует |
|
протеиназа-В |
β-Зигзаг внутри полости |
2 |
|
|
Парвальбумин |
Са2+-связывающий центр и две a-спирали |
2 |
2 |
|
+1 |
Отсутствует |
||
|
Ферредоксин |
FeS-кластер и 27 остатков |
2 |
2 |
|
Глицеральдегид-3-фосфатдегидрогеназа лактатдегидрогеназа s-малатдегидрогеназа алкогольдегидрогеназа фосфоглицераткиназа фосфорилаза |
Свертывание по Россману из трех параллельных ß-структурных цепей и двух соединительных фрагментов |
2 |
2 |
|
Триозофосфатизомераза пируваткиназа |
(βaβ-Структурное образование |
8 |
8 |
|
Аглютинин пшеничного зерна |
41 остаток с 4 мостиками S—S |
4 |
Линейная группа |
|
Гемеритрин |
Две антипараллельных a-спирали |
2 |
2 |
|
Роданеза |
Один домен |
2 |
2 |
|
Иммуноглобулин |
V-домен |
4 на молекулу |
2 |
|
Домены Сн1 и Сн3 |
6 на молекулу |
2 |
|
|
Глутатионредуктаза |
Четырехцепочечная параллельная 3-структура и ß-зигзаг |
2 |
Отсутствует |
|
Кислая протеаза |
Один домен |
2 |
2 |
|
L-Арабиноза-связывающий белок |
» |
2 |
2 |
а См. литературу в табл. 5.2.

Рис. 5.16. Точечная симметрия.
а — изображение точечных групп 2 (С2), 222 (D2), 32 (D3) и 532 (Y, икосаэдр). Цифрами обозначены поворотные оси 2-го, 3-го и т. д. порядков, б — образующие предпочтительный контакт асимметричные элементы. В общем случае такой предпочтительный контакт не приводит к точечной группе. Образование линейной группы также может быть запрещено из-за стерических трудностей. В приведенном примере отсутствует связывающая энергия между первым и пятым звеньями и поэтому пятый контакт не вносит вклад в стабильность. Из-за дополнительной связывающей энергии предпочтительны полностью замкнутые, высокосимметричные структуры.
* В агглютинине зерна пшеницы обнаружена открытая структура из четырех единиц, образующих три очень сходных контакта [253]. Это показывает, что особенно прочный трижды повторенный, контакт может быть выгоднее, чем альтернативный контакт, удовлетворяющий симметрии и потому повторенный четыре раза.
На основании симметрии можно выявить структурные единицы, которые свертываются отдельно. Полипептидная цепь представляет структуру ограниченной величины. Если в процессе свертывания структурные домены, сверхвторичные структуры и другие структурные элементы образуются независимо на начальной стадии, а затем агрегируются, они подчиняются правилу ассоциации отдельных единиц и будут стремиться образовывать симметричные расположения.

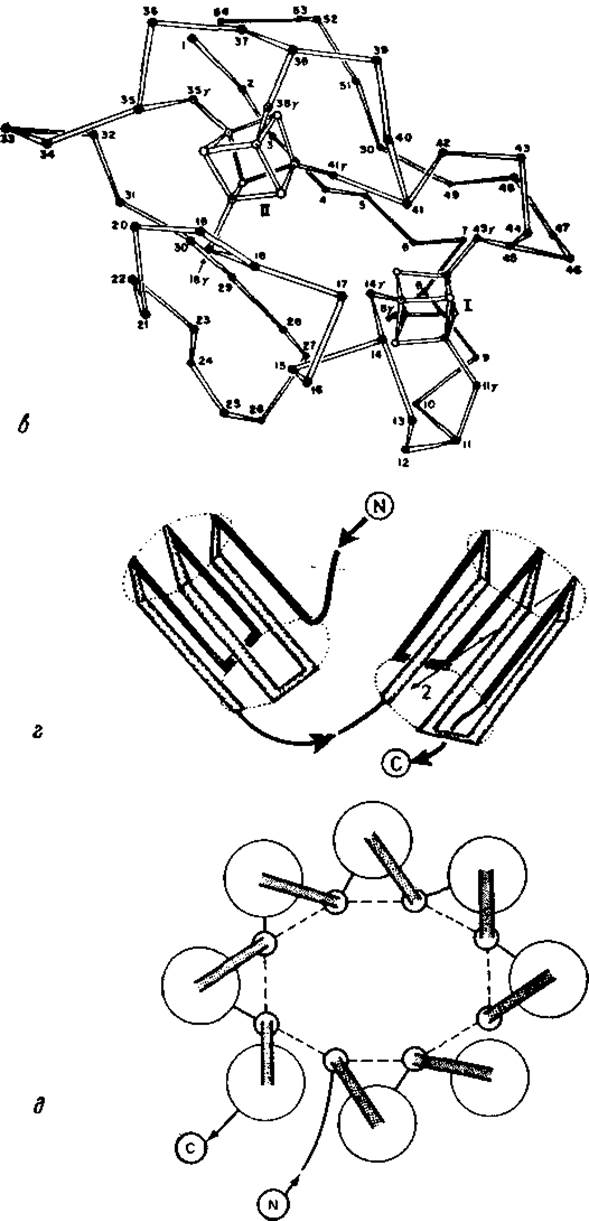
Рис. 5.17. Симметрия одиночных полипептидных цепей.
а — стереопроекция основной цепи роданезы [799]. Если не учитывать короткого промежуточного участка, связь между верхней и нижней половинами цепи почти точно передается поворотной осью 2-го порядка, перпендикулярной плоскости рисунка, б — топология ß-структуры нуклеотидсвязывающего домена NAD-зависимой дегидрогеназы. а-Спирали показаны волнистыми линиями. Структура содержит два участка цепи, свернутых по Россману (рис. 5-12,6), связанных вертикальной осью 2-го порядка, в — схема основной цепи ферредокснна [314] с FeS-кластерами. Некоторые аминокислоты, FeS-кластеры и часть свернутых участков цепи имеют в качестве элемента симметрии ось 2-го порядка; она приблизительно перпендикулярна плоскости рисунка, г — топология двух цилиндрических образований из ß-структур в химотрипсине и в некоторых других трипсиноподобных протеазах. Как видно, каждый цилиндр имеет приближенную внутреннюю симметрию поворотной оси 2-го порядка. Вся молекула лишена какой-либо симметрии. д — топология ß-структуры в триозофосфатизомеразе [305], включающая восемь параллельных складчатых листов и окружающие спирали. Если пренебречь эллиптичностью сечения полости и различиями спиралей, можно допустить симметрию поворотной оси 8-го порядка.
Поскольку структурные домены, по-видимому, являются единицами свертывания, то симметричное расположение доменов, наблюдаемое в роданезе (рис. 5.17, а) и иммуноглобулинах (табл. 5.3), объяснимо. Можно предположить, что в симметрически связанных сверхвторичных структурах домены образуются преимущественно на начальной стадии процесса свертывания, так как они сами по себе достаточно стабильны. Последующая агрегация создает симметрию. Симметричные сверхвторичные структуры обнаружены в виде ßaßaß-звена дегидрогеназы (рис. 5.12, б и 5.17, б), в виде ßaß-звеньев триозофосфатизомеразы и пируват-киназы (рис. 5.17, д), а также в виде ß-зигзагов в полости ß-структуры Ser-протеаз (рис. 5.17, г) и в виде антипараллельных пар a-спиралей в гемеритрине.
Полипептидную цепь ферредоксина (рис. 5.17, в) можно разбить на две симметрично связанные половины. Каждая половина цепи свернута вокруг одного FeS-кластера. Кластеры связаны между собой симметрией. Симметричная структура, образованная FeS-кластерами и окружающими их полипептидными цепями, довольно стабильна. Аналогичная ситуация обнаружена в парвальбумине, который образован двумя симметрично связанными структурными элементами, каждый из которых состоит из Са2+-связывающего центра и двух a-спиралей, расположенных от него в противоположных направлениях [59]. На первый взгляд, такая вытянутая структура сама по себе не должна быть стабильной. Однако симметричное расположение дает основание предположить, что энергия на участке связывания Са2+ достаточна для стабилизации этого структурного элемента в растворе. Таким образом, симметрия позволяет выявить стабильные структурные элементы, а в некоторых случаях указывает на определенную последовательность образования структур в процессе свертывания.