Принципы структурной организации белков - Г. Шульц 1982
Предсказание вторичной структуры по аминокислотной последовательности
Физико-химические методы
Mетоды, основанные на стереохимических данных
Реверсивные повороты содержат главным образом полярные остатки. Простой стереохимический подход для предсказания поворотов цепи был предложен Кунтцем [203]. Автор обратил внимание на то, что повороты располагаются почти исключительно на поверхности белка. В связи с этим он высказал предположение, что все триплеты полярных остатков (обозначенные буквой Т в табл. 6.2) имеют конформацию реверсивного поворота.
Спирали, находящиеся между гидрофобным ядром и растворителем, можно узнать по расположению в них неполярных остатков. С помощью графов, содержащих пять витков спирали, Шиффер и Эдмундсон [376, 377] показали, что неполярные остатки группируются на одном краю спирали, образуя неполярные дуги. Пример такого «a-спирального колеса» показан на рис. 6.1. Для предсказания спирали авторы исследовали наличие неполярных триплетов в положениях і, і + 3, і + 4 (относительные положения 1-4-5), а также в положениях і, і—3, і—4 (1-2-5) данной аминокислотной последовательности. Затем эти положения были приняты за спиральные нуклеации и относительно них были построены «спиральные колеса». Предполагалось, что спираль будет наращиваться в обоих направлениях до тех пор, пока неполярная дуга не будет прервана полярными остатками или остатком Pro. Этот метод предназначался для поиска спиралей, экранирующих гидрофобное ядро от растворителя, как в случае миоглобина. Обнаружить с его помощью спирали в других положениях более трудно.
Расположение неполярных остатков в а-спиралях было рассмотрено также Палау и Пигдоменечом [378], которые использовали значительно больший базовый набор. Эти авторы показали, что частота встречаемости неполярных триплетов в относительных положениях 1-2-5 и 1-4-5 в а-спиралях значительно выше, чем можно было ожидать по аминокислотному составу этих спиралей. Очень часто эти триплеты располагались в виде цепей 1-2-5-"1"-"4"-"5'' →1-2-5-8-9, т. е. образовывали дуги на «а-спиральном колесе» (рис. 6.1). Таким образом, наблюдения Шиффера и Эдмундсона, основывающиеся только на данных по трем белкам, подтвердились для большего базового набора.
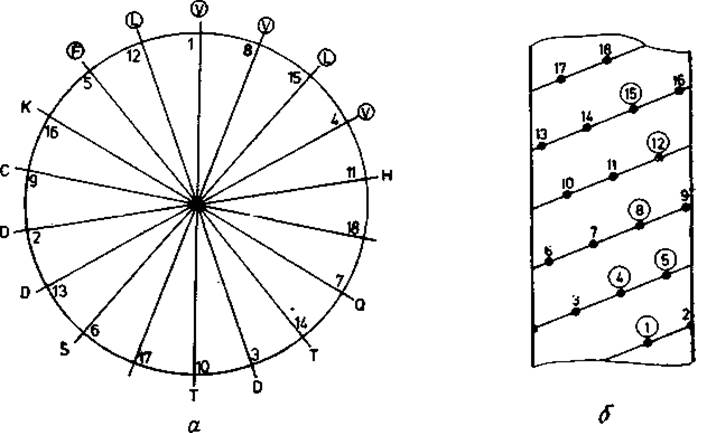
Рис. 6.1. Спиральный круг С-концевой а-спирали аденилаткиназы. а — круг представляет собой проекцию положений всех боковых цепей вдоль осп спирали на плоскость. Остаток в положении 1—Val-179, а последний остаток в положении 16—Lys-194. Неполярные остатки (обведены кружками) располагаются с одной стороны спирали, которая в трехмерной структуре [186] обращена к гидрофобному ядру; другая сторона спирали составляет часть внешней поверхности молекулы. б — положения боковых цепей на цилиндрической диаграмме а-спирали (рис. 5.2). Остатки, образующие неполярные дуги, обведены кружками.
Метод, выявляющий расположение остатков в спиралях и β-складчатых листах. Рассмотрение нуклеаций неполярных остатков было использовано также Лимом в его предсказаниях вторичной структуры [379, 380]. Аналогично Палау и Пигдоменечу [378], он обратил внимание на расположение триплетов в относительных положениях 1-2-5 и 1-4-5, а также дублетов в положениях 1-4 и 1-5. Если боковые цепи были слишком объемными, образование кластеров не обсуждалось. Учитывалось также влияние полярных остатков в том аспекте, что крупные полярные остатки могут стабилизировать соседние неполярные кластеры путем экранирования их от растворителя. В предсказании ß-структуры различались внутренние, полуповерхностные и поверхностные ß-листы. Поверхностные листы имеют полярную и неполярную стороны, поэтому в них должно наблюдаться альтернирование полярных и неполярных остатков. Напротив, во внутренних листах неполярные остатки расположены по обе стороны, и, таким образом, эти структуры можно идентифицировать по непрерывному чередованию неполярных остатков. Такие сегменты обычно экранируются крупными полярными остатками на концах цепи. В полуповерхностных листах все боковые цепи расположены наклонно к поверхности, как, например, в случае С-концевого ß-листа центральной ß-структуры аденилаткиназы, показанной на рис. 7.6. Такие ß-листы могут не содержать крупных неполярных остатков, поскольку нет необходимости в их экранировке от растворителя.
Лим сформулировал свои соображения в виде 22 правил для a-предсказаний и 14 правил для ß-предсказаний. Он составил таблицу 17 антиспиральных дублетов и 26 антиспиральных триплетов и сгруппировал типы аминокислотных остатков 14 различными способами. ß-Конформация была постулирована только для областей, в которых не предсказывалась а-спираль. Следует отметить, что правила, предложенные Лимом, содержат большой объем информации, т. е. варьируемых параметров, и, таким образом, их всегда можно согласовать с базовым набором, даже если этот набор велик. Таким образом, ценность этого метода можно проверить только путем опробования на неизвестных структурах.