Принципы структурной организации белков - Г. Шульц 1982
Предсказание вторичной структуры по аминокислотной последовательности
Применение предсказательных методов
Простые методы предсказания наиболее популярны. Предсказательные методы обычно требуют громоздких расчетов с использованием больших таблиц (например, метод Нагано [353]), так что для их воспроизведения необходимо получить от авторов программу для ЭВМ, таблицы и параметры, выведенные из базового набора. Некоторые методы можно применять, не прибегая к вычислительной технике, но они настолько сложны, что требуют огромных затрат времени (например, метод Лима [380]. Обычно авторы не пользуются приближениями, которые могли бы упростить применение предсказательного метода. Однако существует несколько простых и в связи с этим наиболее популярных методов. Из них чаще всего, по-видимому, применяется метод Чоу и Фасмана [340]. В качестве простого примера рассмотрим предсказания этого метода для первых 24 остатков аденилаткиназы.
Первым этапом метода Чоу и Фасмана является обнаружение мест инициации спирали и слоя. Предсказания спирали и ß-структуры проводятся независимо и выполняются в связи с этим одновременно. Аминокислотная последовательность, величины, характеризующие склонности остатков к спирали и ß-структуре (табл. 6.1 и 6.2), а также обозначения Н, h, I, i, b, В даны на рис. 6.2.
Первый этап заключается в нахождении центров инициации. Для инициации спирали необходимо наличие гексапептида, содержащего четыре спиралеобразующих остатка hа или На (Iаэквивалентно половине ha), а также не более одного прерывания спирали ba или Ва. Четыре таких пептида, определяющие две нуклеации, показаны на рис. 6.2. Точно так же инициация ß-структуры происходит в том случае, если пентапептид содержит три остатка hβ или Нβ и не более одного остатка bβ и Вβ. Как видно из рис. 6.2, имеются четыре таких пептида, определяющих один центр инициации. Оба центра (спирали и листа) находятся около остатка 12. Для разрешения этой неопределенности сравнивают самые высокие средние склонности. Поскольку склонность к ß-структуре (1,56) выше, чем склонность к спирали (1,09), этот сегмент считают центром инициации ß-структуры.
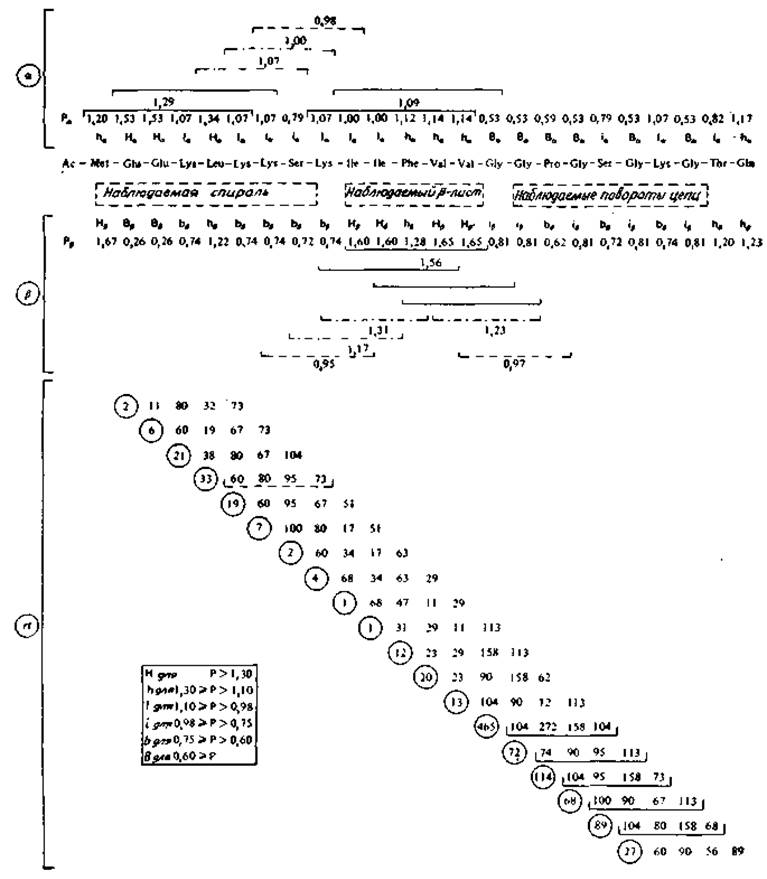
Рис. 6.2. Предсказание а-спирали, ß-структуры и реверсивного поворота (rt) для 24 N-концевых остатков аденилаткиназы [389] с помощью процедуры Чоу и Фасмана [340].
Параметры Ра и Рβ, характеризующие склонность остатков входить в а-спираль и ß-структуру (соответственно а- и ß-потенциалы остатков), взяты из табл. 6.1 и 6.2* Критерии оценки приведены на рисунке в рамке. При предсказании а-спирали гексапептиды со средней склонностью выше 1,00 выделены сплошными линиями. Также обозначены пентапептиды со средней ß-склонностью выше 1,00. Тетрапептидные концевые участки спиралей и складчатых листов со средней склонностью выше 1,00 отмечены штрих- пунктирными, а ниже 1,00 — пунктирными линиями. Склонность остатка входить в поворот цепи зависит от его положения в рассматриваемом тетрапептиде. Таким образом, у каждого остатка выявляются четыре склонности. Все они умножаются на 103. rt-Потенциал является произведением склонностей остатков в тетрапептиде. На рисунке они обведены кружками и приведены в тех же строках, что и rt-склонности тетрапептида. Все потенциалы умножены на 10+6. Тетрапептиды с потенциалами выше 50∙10-6 подчеркнуты сплошными линиями, а несколько ниже этой величины — пунктирной линией»
Нуклеации спирали и ß-структуры наращиваются в обе стороны. На следующем этапе нуклеация спирали с центром на остатке 4 и нуклеация складчатого листа с центром на остатке 12 наращиваются в обоих направлениях до тех пор, пока значение средней склонности тетрапептида не упадет ниже 1,00. Правила не указывают точно, какой из остатков нарушающего тетрапептида следует включать соответственно в спираль и ß-структуру. По-видимому, целесообразно включать только остатки Н, h и I. Таким образом, спираль предсказывается для остатков 1—7, а ß-структура — для остатков 10—14.
Предсказание реверсивного поворота. Для предсказания поворота Чоу и Фасман [340] применили метод Льюиса и сотр. [326] с расширенным базовым набором. Потенциал реверсивного поворота тетрапептида определялся как произведение склонностей к повороту четырех остатков в положениях i, і + 1, і + 2, і + 3 (разд. 6.1). Соответствующие величины показаны на рис. 6.2. С использованием порога 50 ∙ 10-6 повороты были предсказаны для остатков 16—23.
При сравнении предсказанной и наблюдаемой вторичной структуры в данном случае обнаруживается хорошее соответствие: предсказанная спираль на один остаток короче, а ß-лист и поворот предсказаны точно. Однако приведенный пример не очень показателен в том отношении, что в рассматриваемом случае потенциалы а, ß и rt весьма высоки и явно различаются. Обычно в реальных структурах ситуация менее определена и предсказания значительно менее точны.