БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 35. ДЕЙСТВИЕ ГОРМОНОВ
35.8. Инсулин стимулирует анаболические процессы и ингибирует катаболические процессы
Обратимся теперь к инсулину - полипептидному гормону, играющему ключевую роль в интеграции процессов использования топливных веществ, что уже обсуждалось выше (разд. 23.6). Общая характеристика функции инсулина состоит в том, что в мышцах печени и жировой ткани он усиливает анаболические и ингибирует катаболические процессы. В частности, инсулин повышает скорость синтеза гликогена, жирных кислот, белков, а также стимулирует гликолиз. Важное значение имеет такой аспект действия гормона, как стимуляция проникновения глюкозы, ряда других сахаров, а также аминокислот в клетки мышц и жировой ткани. Способствуя входу глюкозы в указанные клетки, гормон снижает ее содержание в крови (так называемый гипогликемический эффект). Инсулин ингибирует такие катаболические процессы, как распад гликогена и нейтрального жира. Он тормозит также гликонеогенез путем снижения уровня ферментативной активности пируват-карбоксилазы и фруктозо-1,6-бисфосфатазы. Действие инсулина во многом противоположно действию адреналина и глюкагона. По существу, адреналин и глюкагон служат сигналами недостаточности глюкозы, тогда как инсулин - сигнал избытка глюкозы.
35.9. Препроинсулин и проинсулин - предшественники активного гормона
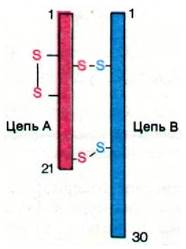
Как показал Фредерик Сангер (Frederik Sanger), бычий инсулин состоит из двух цепей: А-цепи из 21 аминокислотного остатка и В-цепи из 30 остатков; цепи инсулина ковалентно связаны между собой двумя дисульфидными мостиками (рис. 35.9). Аналогичное строение имеют инсулины других видов животных, в том числе человека. Как синтезируется этот двухцепочечный белок? A priori можно предположить, что А- и В-цепи синтезируются по отдельности, затем они специфически связываются в результате нековалентных взаимодействий и далее между ними формируются правильно расположенные дисульфидные мостики. Такое предположение было проверено экспериментально; для этого определяли, можно ли из восстановленных А- и В-цепей получить in vitro активный гормон с правильным расположением дисульфидных мостиков. Стимулом для этого исследования послужили данные Анфинсена (Anfinsen), посвященные рибонуклеазе - одноцепочечному белку, способному к полной ренатурации после химического восстановления и развертывания структуры (разд. 2.12). Однако в случае инсулина был получен совершенно иной результат: менее 4% образованных in vitro молекул содержали правильные дисульфидные пары. Такой же низкий выход ренатурированного белка имел место и в случае с химотрипсином - трехцепочечным ферментом, имеющем две межцепочечные дисульфидные связи (разд. 8.2). С другой стороны, химотринсиноген - одноцепочечный предшественник химотрипсина - восстанавливал свою структуру в значительно большей мере. Различие в поведении химотрипсина и химотрипсиногена наводило на мысль о том, что и инсулин не восстанавливал структуры должным образом из-за частичного отсутствия необходимой для этого информации. Возник вопрос, не является ли инсулин, подобно химотрипсину, производным одной полипептидной цепи?
Рис. 35.9. Полипептидные цепи и дисульфидные мостики в инсулине
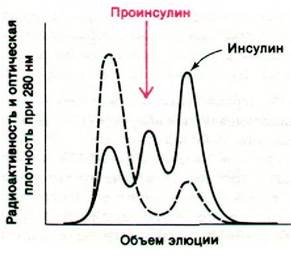
Решающую роль в изучении этой проблемы сыграла работа Доналда Стайнера (Donald Steiner), проведенная на аденоме островковой ткани поджелудочной железы. Эта редко встречающаяся опухоль человека продуцирует большие количества инсулина. Стайнер инкубировал срезы опухоли с меченным тритием лейцином и далее проводил анализ. Таким путем был обнаружен новый включавший большое количество метки белок (рис. 35.10). Последующие исследования показали, что этот белок, названный проинсулином, служит предшественником инсулина.
Рис. 35.10. Изучение белка с высокой радиоактивностью, выявляемой после импульсного введения метки в аденому островковой ткани поджелудочной железы, привело к открытию проинсулина (непрерывной линией показана радиоактивность, прерывистой - оптическая плотность при 280 нм)
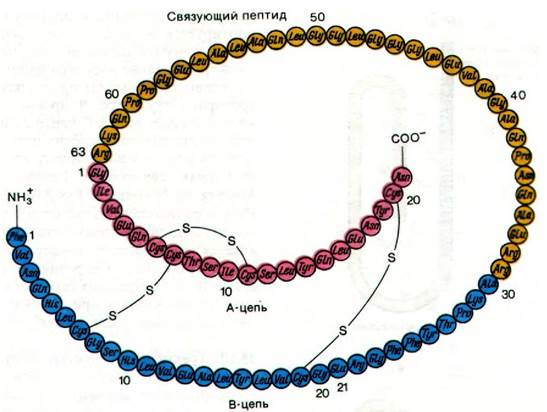
Проинсулин представляет собой единую полипептидную цепь, в которой есть последовательность примерно из 30 аминокислот, отсутствующая в инсулине (рис. 35.11). Это связующий пептид (С-пептид от англ. connecting - связующий); он расположен между карбоксильным концом В-цепи и аминоконцом А-цепи будущего инсулина. Как и предполагалось, проинсулин обладает способностью к формированию правильно расположенных дисульфидных связей после обработки восстанавливающими агентами и последующего повторного окисления.
Рис. 35.11. Последовательность аминокислот в проинсулине свиньи; А-цепь инсулина показана красным цветом, В-цепь - синим, связующий пептид (С-пептид) - желтым
Недавно проведенные исследования биосинтеза инсулина выявили, что проинсулин - это еще не исходная форма синтезированного гормона. Новообразованная полипептидная цепь, попадающая в просвет шероховатого эндоплазматического ретикулума, представляет собой так называемый препроинсулин, который содержит N-концевую последовательность из 16 остатков, отсутствующую в проинсулине. По-видимому, этот N-концевой гидрофобный участок служит сигнальной последовательностью, направляющей новообразованную цепь в эндоплазматический ретикулум (разд. 29.30). Превращение препроинсулина в проинсулин происходит в просвете трубочек эндоплазматического ретикулума вскоре после прохождения препроинсулина через мембрану.
Рис. 35.12. Ферментативное превращение препроинсулина в проинсулин и далее в инсулин

Далее образовавшийся проинсулин транспортируется в аппарат Гольджи, где начинается протеолиз соединительного пептида. Формирование инсулина из проинсулина (неактивного гормона) продолжается в секреторных гранулах. В проинсулинах животных разных видов С-пептиды имеют общие структурные особенности. Так, во всех изученных к настоящему времени проинсулинах связующий пептид содержит Arg-Arg на N-конце и Lys-Arg на С-конце. Гидролиз полипептидной цепи по этим положительно заряженным остаткам осуществляется протеолитическим ферментом, сходным с трипсином. Секреция инсулина, накопленного в созревших секреторных гранулах, осуществляется при слиянии мембран гранул с плазматической мембраной клетки.
35.10. Трехмерная структура инсулина
В лаборатории Дороти Ходжкин (Dorothy Hodgkin) было проведено рентгеноструктурное исследование инсулина свиньи и раскрыта его трехмерная пространственная структура при разрешении 1,9 А. Эта работа была завершена почти через 36 лет после того, как Ходжкин получила первые рентгенограммы кристалла белка (пепсина), будучи студенткой-дипломницей в лаборатории Джона Бернала (John Bernal). За прошедшие годы Ходжкин расшифровала структуры таких биологически важных веществ, как холе- стерол, пенициллин и витамин В12. Инсулин оказался компактным трехмерным образованием (рис. 35.14), из которого «торчат» только N и С-концы В-цепи. Между этими двумя вытянутыми ветвями В-цепи располагается А-цепь. Структура имеет неполярную сердцевину, образованную обращенными внутрь алифатическими боковыми цепями остатков аминокислот, принадлежащих А- и В-цепям. Помимо дисульфидных мостиков, инсулин стабилизирован несколькими солевыми связями, а также водородными связями между определенными группами А- и В-цепей. Конформация проинсулина еще не исследована, но, судя по данным спектроскопии, она очень сходна с конформацией инсулина. Об этом же свидетельствует способность проинсулина кристаллизоваться вместе с инсулином.
Рис. 35.13. Электрононграмма содержащих инсулин секреторных гранул в β-клетках поджелудочной железы. Инсулин образует в гранулах мелкие кристаллы, что обусловлено его высокой концентрацией в этих структурах
Рис. 35.14. Схематическое изображение структуры инсулина; показаны только α-углеродные атомы. Красным обозначена А-цепь, синим - В-цепь
