БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 35. ДЕЙСТВИЕ ГОРМОНОВ
35.5. Циклический AMP активирует протеинкиназы
Каким образом сАМР воздействует на столь большое число различных клеточных процессов? Есть ли в этих воздействиях что- либо общее? Действительно, такая общность имеется, и обнаружена она была опять-таки при изучении регуляции обмена гликогена - участка метаболизма, где «родился» сАМР. Эдвин Кребс и Донал Уолш (Edwin Krebs, DonalWalsh) установили, что сAMP активирует протеинкиназу в скелетных мышцах. Протеинкиназа фосфори- лирует как гликоген-синтазу (переводя ее в неактивное состояние), так и киназу фосфорилазы (переводя ее в активное состояние). Таким путем сАМР стимулирует распад гликогена и ингибирует его синтез в мышцах (разд. 16.15). Аналогичный механизм действует в печени. По существу, все известные эффекты сАМР обусловлены активацией протеинкиназ. Все исследованные до сих пор клетки содержат протеинкиназы, которые активируются под действием сАМР в концентрации порядка 10-8 М. Эти киназы модулируют активность различных белков путем их фосфорилирования.
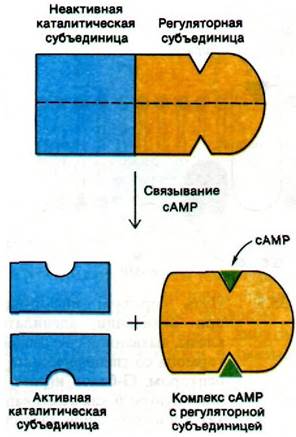
Интересен механизм активации протеинкиназы мышц циклическим AMP. Этот фермент состоит из субъединиц двух типов: регуляторной (R) субъединицы (49 кДа), связывающей сАМР, и каталитической (С) субъединицы (38 кДа). В отсутствие сАМР регуляторная и каталитическая субъединицы образуют комплекс R2C2, лишенный ферментативной активности. Присоединение сАМР к каждой из регуляторных субъединиц приводит к диссоциации комплекса R2C2 на одну R2-субъединицу и две С-субъединицы. Свободные каталитические субъединицы обладают ферментативной активностью. Следовательно, присоединение сAMP к регуляторной субъединице снимает ингибирование каталитической субъединицы. сАМР при этом функционирует как аллостерический эффектор. Своей субъединичной структурой (наличием отдельных регуляторных и каталитических субъединиц) протеинкиназа напоминает аспартат-транскарбамоилазу (разд. 22.14).
Рис. 35.6. сАМР активирует протеинкиназу, вызывая диссоциацию комплекса регуляторных и каталитических субъединиц фермента
35.6. Циклический AMP - эволюционно древний сигнал голодания
Как было описано выше (разд. 28.6), сАМР оказывает регуляторное действие на клетки бактерий, у которых он стимулирует транскрипцию определенных генов. Очевидно, что сАМР как вещество-регулятор имеет длинную эволюционную историю. У бактерий сАМР служит сигналом голодания. Появление сАМР свидетельствует об отстут- ствии глюкозы и ведет к синтезу ферментов, необходимых для использования других источников энергии. В некоторых клетках млекопитающих, таких, как клетки печени и мышц, сАМР сохраняет свою древнюю функцию сигнала голодания, но при этом действие сАМР направлено на стимуляцию протеинкиназы, а не на усиление транскрипции определенных генов. Еще одно важное различие состоит в том, что у высших организмов сАМР стал вторым посредником, участвуя во внутриклеточных, а не внеклеточных коммуникативных связях.
Почему в ходе эволюции сАМР превратился во второго посредника? Представляется, что здесь сыграли роль три фактора.
1. сАМР образуется из повсеместно присутствующего АТР в ходе несложной реакции, протекающей за счет энергии последующего гидролиза пирофосфата.
2. Будучи производным вещества, занимающего центральное положение в метаболических превращениях, сам сАМР стоит в стороне от основных путей метаболизма. сАМР используется только как интегратор обмена веществ и не является ни предшественником в процессах биосинтеза, ни промежуточным продуктом в энергетическом обмене. Вследствие этого концентрация сАМР может регулироваться однозначно. Более того, сАМР стабилен, если не подвергается действию специфической фосфоди- эстеразы.
3. сАМР обладает достаточным количеством функциональных групп, которые обеспечивают прочное и специфическое связывание с рецепторными белками (например, с регуляторной субъединицей протеинкиназы мышц) и развитие соответствующих аллостерических эффектов.
Важно отметить, что использование сАМР как второго посредника приводит к значительному усилению гормонального сигнала. Так, многие гормоны в крови присутствуют в концентрациях порядка 10-10 М. В стимулированных клетках-мишенях концентрация сАМР намного выше, так как каждая активированная молекула аденилатциклазы синтезирует много молекул сАМР. Фосфорилирование множества молекул белка молекулой протеинкиназы, активированной сАМР, представляет собой еще один этап усиления гормонального сигнала. Каскад ферментативных реакций, регулирующих обмен гликогена, служит примером того, как малые стимулы могут вызвать значительные изменения метаболизма клетки.
Рис. 35.7. Пространственная модель сАМР

35.7. Холерный токсин стимулирует аденилаткиназу, ингибируя GTP-азную активность G-белка
Непосредственное участие сАМР в патологических процессах было четко установлено при холере. Возбудителем этого потенциально смертельного заболевания является Vibriocholerae - грамотрицательная бактерия с одним жгутиком, с помощью которого она движется. Основное клиническое проявление холеры - сильнейший понос (диарея). В течение нескольких часов организм может потерять несколько литров жидкости, и если потерю жидкости не возместить, то развивается шок и наступает смерть. Диарея обусловлена не прямым действием бактерии, а бактериальным токсином. Холерный токсин (называемый также холерагеном) повышает активность адени- латциклазы в слизистой тонких кишок, которая в свою очередь повышает содержание сАМР в клетках, причем до исключительно высокого уровня. Последнее стимулирует активный транспорт ионов в кишечном эпителии, вследствие чего резко возрастает выход Na+ и воды в полость кишечника.
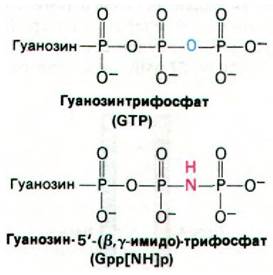
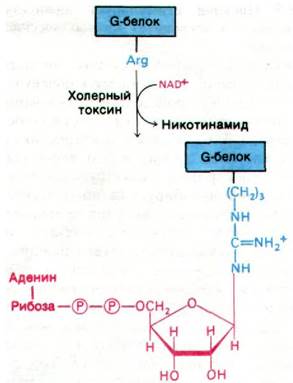
Холерный токсин - белок массой 87 кДа; он состоит из A1 и А2-пептидов, соединенных дисульфидным мостиком, и пяти В- пептидов. Токсин проникает в клетку путем взаимодействия с ганглиозидом GM1 (разд. 20.7) на ее поверхности. Этот богатый углеводами сфинголипид узнают В-цепи токсина. Попав в клетку, А1-субъединица (23 кДа) ковалентно модифицирует G-белок, регулирующий активность аденилатциклазы. В частности, А1-субъединица токсина катализирует перенос ADP-рибозы от NAD на боковую цепь аргинина G-белка (рис. 35.8). Это ADP-рибозилирование блокирует GTP-азную активность G-белка. Другими словами, модифицированный G-белок лишается встроенного в него устройства для инактивации аденилатциклазы (см. рис. 35.5). По существу, G-белок оказывается стабилизированным в GTP-форме, а аде- нилатциклаза - в непрерывно активированном состоянии, несмотря на отсутствие гормона. Аналогичный эффект можно получить in vitro путем добавления к немодифицированному G-белку гуанилилимидоди- фосфата - негидролизуемого аналога GTP.
Рис. 35.8. Холерный токсин катализирует ADP-рибозилирование G-белка - регулятора активности аденилатциклазы
Этот аналог, подобно GTP, активирует G- белок, но не способен превращаться в GDP. Связывание гуанилилимидодифосфата с немодифицированным G-белком так же активирует аденилатциклазу, как связывание GTP G-белком, утратившим GТРазную активность. Действие холерного токсина еще раз доказывает значение GТРазной активности G-белка. Вспомним, что вредоносное действие дифтерийного токсина также обусловлено ADP-рибозилированием белка с GТРазной активностью (разд. 29.28).