БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 35. ДЕЙСТВИЕ ГОРМОНОВ
35.2. Циклический AMP синтезируется аденилатциклазой и расщепляется фосфодиэстеразой
сАМР образуется из АТР под действием мембранного фермента аденилатциклазы:
![]()
Эта реакция в небольшой степени эндергонична; ее ∆G°' составляет около 1,6 ккал/ моль. Источником энергии для синтеза сАМР служит последующий гидролиз пирофосфата. Специфическая фосфодиэстераза разрушает сАМР путем гидролиза до AMP:
![]()
Это высокоэкзергоническая реакция с ∆G°' около —12 ккал/моль. В отсутствие фосфодиэстеразы сАМР - очень стабильное соединение.
35.3. сАМР служит вторым посредником при действии многих гормонов
Работа Сазерленда привела к созданию концепции о роли сАМР как второго посредника в механизме действия некоторых гормонов. Первым посредником является сам гормон. Сущность этой концепции заключается в следующем.
1. Плазматические мембраны клеток содержат рецепторы гормонов.
2. Взаимодействие гормона с его специфическим рецептором на плазматической мембране ведет к стимуляции аденилатциклазы, также связанной с плазматической мембраной.
3. В результате активации аденилатциклазы в клетке увеличивается содержание сАМР.
4. Действие сАМР проявляется внутри клетки и состоит в изменении скорости одного или более процессов.
Важная особенность этой гипотезы второго посредника состоит в том, что она не предполагает проникновения гормона в клетку. Действие самого гормона ограничивается клеточной мембраной. Биологический эффект гормона опосредован действием сАМР внутри клетки; непосредственного действия сам гормон не оказывает. Обоснованность этой концепции была проверена с использованием целого ряда экспериментальных критериев, а именно:
1. Аденилатциклазу клетки должны стимулировать те гормоны, которые действуют на эту клетку как на мишень. Гормоны, не вызывающие специфического биологического ответа данной клетки, не должны повышать в ней активности этого фермента.
2. Концентрация сАМР в клетках-мишенях должна изменяться пропорционально биологическому ответу этих клеток на гормональную стимуляцию, т.е. она должна проявлять временную и количественную зависимость от концентрации гормона.
3. Ингибиторы фосфодиэстеразы, например, теофиллин или кофеин, должны действовать синергично с теми гормонами, эффект которых опосредован сАМР как вторым посредником.
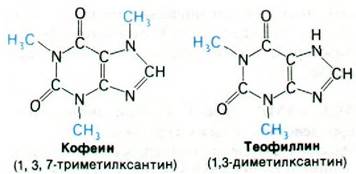
4. Добавление сАМР или родственного ему соединения к клеткам-мишеням должно имитировать биологическое действие гормона. (На практике сАМР в таких опытах не используется, так как он плохо проникает в клетки; однако менее полярные производные сАМР, в частности дибутирил- сАМР, проникают в клетки и оказывают свое действие.)
Проведенные опыты показали, что циклический AMP является вторым посредником при действии не только адреналина и глюкагона, но и многих других гормонов (табл. 35.1). сАМР оказывает влияние на исключительно большое число клеточных процессов. Так, под действием этого соединения увеличивается распад накопленных запасов топливных веществ, повышается выделение соляной кислоты слизистой желудка, происходит дисперсия пигментных гранул меланина, уменьшается агрегация тромбоцитов.
Таблица 35.1. Гормоны, действие которых опосредовано сАМР

35.4. Сопряжение рецепторов гормонов с аденилатциклазой осуществляется белком, связывающим гуаниннуклеотиды
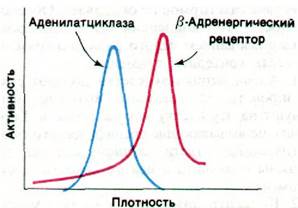
Каким образом связывание гормона типа адреналина или глюкагона со специфическим рецептором приводит к активации молекулы аденилатциклазы? Участки связывания этих гормонов локализованы на наружной поверхности плазматической мембраны, тогда как каталитические участки аденилатциклазы обращены к цитозолю. В сущности, участки связывания гормона и каталитические участки принадлежат разным белкам, которые можно разделить при центрифугировании плазматической мембраны в растворе детергента (рис. 35.4). Аденилатциклаза (185 кДа) и рецептор адреналина (75 кДа) представляют собой большие интегральные белки мембраны. Рецептор адреналина называют также β-адренергическим рецептором, поскольку он связывает целый ряд фармакологически активных соединений.
Рис. 35.4. Разделение аденилатциклазы и β-адренергического рецептора центрифугированием солюбилизированной (в растворе детергента) плазматической мембраны в градиенте плотности сахарозы
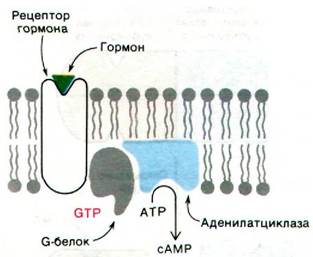
Связывание гормона со специфическим рецептором оказывает активирующее действие на аденилатциклазу не прямо, а опосредованно - через третий белок, называемый G-белком1 (от англ. guanyl, поскольку этот белок связывает гуаниннуклеотиды). Этот регуляторный белок (42 кДа) существует в двух формах. Комплекс G-белка с GTP активирует аденилатциклазу, тогда как комплекс G-белка с GDP такого действия не оказывает. G-белок превращается из неактивной GDP-формы в активную GTP-форму в результате обмена связанного GDP на GTP. Этот GTP-GDP-обмен катализируется гормон-рецепторным комплексом, но не свободным рецептором. Таким образом, путь передачи информации идет от рецептора гормона на G-белок и далее на аденилатциклазу (рис. 35.5).
1 В отечественной литературе чаще используется обозначение N-белок. Прим. перев.
Рис. 35.5. Путь передачи информации при активации аденилатциклазы, вызванной связыванием гормона со специфическим рецептором. G-белок играет решающую роль как в активации, так и в инактивации аденилатциклазы
Как происходит выключение аденилатциклазы? G-белок обладает еще одним свойством, благодаря которому он может передавать информацию от рецепторов гормона на аденилатциклазу. Дело в том, что связанный с G-белком GTP медленно гидролизуется до ADP. Другими словами, G-белок является GТРазой. Следовательно, этот регуляторный белок содержит встроенное в него устройство для инактивации аденил- атциклазы. Доля G-белка, находящегося в комплексе с GTP, а соответственно и степень активации аденилатциклазы зависят от отношения скорости обмена GDP на GTP к скорости гидролиза GTP. Скорость GTPGDP-обмена значительно возрастает при связывании G-белка с комплексом гормон-рецептор. Следовательно, при низком содержании гормона почти весь G-белок находится в GDP-форме и соответственно почти вся аденилатциклаза неактивна. В некоторых клетках активация аденилатциклазы зависит также от концентрации Са2+. Для активации аденилатциклазы в этих клетках необходим не только G-белок в GTP-форме, но и комплекс Са2+ с кальмодулином (белок массой 17 кДа). Таким образом, в настоящее время начал проясняться вопрос о том, какие регуляторные циклы определяют активность аденилатциклазы.