БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.26. ДНК содержит тимин вместо урацила, что делает возможной репарацию дезаминированного цитозина
Цитозин в ДНК спонтанно дезаминируется с измеримой скоростью, образуя урацил.
Дезаминирование цитозина является потенциально мутагенным, так как образующийся урацил спаривается с аденином, и, следовательно, одна из дочерних цепей будет содержать AU-пару оснований вместо исходной GС-пары:

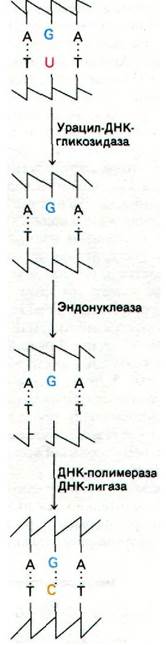
Эта мутация исправляется под действием репарационной системы, узнающей чужеродный урацил в молекуле ДНК (рис. 24.47). Прежде всего урацил- ДНК—гликозидаза гидролизует гликозидную связь остатка урацила с дезоксирибозой. На этом этапе остов ДНК остается интактным, но одно основание отсутствует. Затем специфическая эндонуклеаза узнает этот дефект и расщепляет остов рядом с отсутствующим основанием. ДНК-полимераза I вырезает оставшийся дезоксирибозо- фосфат и вставляет цитозин, комплементарный гуанину в неповрежденной цепи. Наконец, репарированная цепь заделывается ДНК-лигазой.
Рис. 24.47. Остатки уранила в ДНК вырезаются и замещаются цитозином - исходным основанием
В течение многих лет оставалось загадкой, почему в ДНК присутствует тимин, а не урацил, ведь оба основания спариваются с аденином. Единственное различие между ними - метильная группа тимина на месте атома водорода при С-5 в урациле. Почему это метилированное основание используется в ДНК, но не в РНК? Напомним, что на метилирование дезоксиуридилата с образованием дезокситимидилата расходуется много энергии (разд. 22.16). Открытие сравнительно недавно активной системы, репарируюшей дезаминирование цитозина, служит убедительным ответом на эту загадку. Урацил-ДНК—гликозидаза не удаляет тимина из ДНК. Таким образом, метильная группа тимина служит меткой, позволяющей отличать его от дезаминированного цитозина. Если бы этой метки не было, урацил, стоящий на правильном месте, было бы невозможно отличить от урацила, образовавшегося в результате дезаминирования. Дефект остался бы незамеченным, и в одной из дочерних молекул ДНК неизбежно произошло бы мутационное замещение одной GC-пары на AU-пapy. Система репарации, которая выискивает урацилы и оставляет тимины, подавляет такие мутации. По всей вероятности, тимин используется в ДНК вместо урацила для увеличения надежности генетической информации. В противоположность этому РНК не репарируется, и в ней используется урацил, так как он представляет собой менее дорогой строительный блок.
24.27. Рестриктирующие эндонуклеазы совершили переворот в анализе ДНК
Ферменты рестрикции - эндонуклеазы, способные узнавать определенные последовательности оснований в двухспиральной ДНК и расщеплять обе цепи. Эти исключительно тонкие скальпели - великолепный подарок природы биохимикам. Существование ферментов рестрикции позволило проводить эксперименты, о которых нельзя было даже и мечтать всего лишь несколько лет назад. Они представляют собой незаменимые инструменты для исследования структуры хромосомы, определения последовательности нуклеотидов в очень длинных молекулах ДНК, выделения генов и получения новых молекул ДНК для клонирования. Разработку всех этих методов начали Вернер Арбер, Гамилтон Смит и Дэниел Натанс (Werner Arber, Hamilton Smith, Daniel Nathans).
Палиндром (перевертыш) - слово, предложение или стих, которые читаются одинаково слева направо и справа налево.
Примеры:
Радар
То не ясли ломал, а молился енот.
А роза упала на лапу Азора.
Нажал кабан на баклажан.
Roma tibi subito motibus ibit amor.
Происходит от греческого слова palíndromos - бегу назад.
Рестриктирующие эндонуклеазы обнаруживаются у самых различных прокариот. Биологическая роль этих ферментов состоит в том, чтобы расщеплять чужеродные молекулы ДНК. Собственная клеточная ДНК при этом не расщепляется, так как участки, узнаваемые своими ферментами рестрикции, у нее метилированы. Взаимосвязь между ресткрикцией и модификацией рассматривается в гл. 30 (разд. 30.9). Важное значение имеет тот факт, что многие ферменты рестрикции узнают специфические последовательности ДНК длиной от четырех до шести пар оснований и гидролизуют фосфодиэфирные связи в обеих цепях в этой области. Удивительная особенность таких участков расщепления - их симметрия относительно оси вращения второго порядка. Другими словами, узнаваемая последовательность пар оснований представляет собой палиндром.
Расщепляемые участки расположены симметрично относительно оси второго порядка. Например, фермент рестрикции из Streptomyces achromogenes узнает последовательность
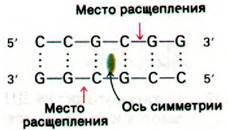
В каждой цепи эта эндонуклеаза рвет фосфодиэфирную связь между G и С, дистальную по отношению к оси симметрии. К настоящему времени очищено и охарактеризовано более 80 ферментов рестрикции. Их названия состоят из сокращенного до трех букв названия микроорганизма (например, Есо от E. coli, Hin от Haemophilus influenzae, Нае от H. aeguptins),обозначения штамма и римской цифры. Специфичность некоторых ферментов показана на рис. 24.48. Обратите внимание, что производимые в двух цепях разрывы могут быть расположены либо со сдвигом относительно друг друга, либо строго против друг друга.
Рис. 24.48. Специфичность некоторых эндонуклеаз рестрикции. Последовательности пар оснований, узнаваемые этими ферментами, имеют ось симметрии второго порядка. Две цепи ДНК в этой области симметричны относительно оси, обозначенной зеленым овалом. (Одна цепь сдвинута относительно другой на 180°.) Места расщепления показаны красными стрелками. Сокращенные названия каждого фермента рестрикции приведены справа от последовательности, которую он узнает

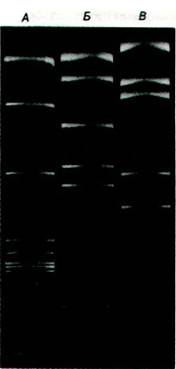
Ферменты рестрикции используются для расщепления молекул ДНК на определенные фрагменты, которые более удобны для анализа и манипулирования, чем исходная молекула. Например, EcoRI расщепляет кольцевую двухцепочечную ДНК вируса SV-40 длиной 5,1 kb только в одном месте, Нра - в четырех местах и Hind - в 11 местах. Кусок ДНК, образованный одним ферментом рестрикции, можно специфически расщепить на более мелкие фрагменты с помощью другого фермента. Используя несколько ферментов рестрикции, можно картировать хромосомы (разд. 31.8). Более того, набор фрагментов, полученных с помощью ферментов рестрикции, может служить своего рода «отпечатком пальца» для соответствующей молекулы ДНК. Небольшие различия между сходными молекулами ДНК можно легко выявить с помощью электрофоретического разделения их рестрикционных фрагментов. Для каждого данного геля электрофоретическая подвижность фрагмента ДНК обратно пропорциональна логарифму числа пар оснований (до определенного предела длины фрагментов). Для разделения фрагментов ДНК длиной до 1000 пар оснований используют полиакриламидный гель, а для разделения более длинных молекул более пористый агарозный гель. Если ДНК содержит радиоактивную метку, полосы можно выявить методом радиоавтографии. В другом случае гель можно покрасить бромистым этидием, который при связывании с двухспиральной ДНК флуоресцирует ярким оранжевым светом. При использовании этого способа можно легко увидеть полосу, содержащую 50 нг ДНК (рис. 24.49). Помимо чувствительности, важное достоинство таких гелей - их высокая разрешающая способность.
Рис. 24.49. Электрофоретическое разделение фрагментов, образующихся при расщеплении ДНК SV-40 тремя различными ферментами рестрикции. Эти фрагменты флуоресцируют благодаря тому, что гель окрашен бромистым этидием