БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.28. Последовательность нуклеотидов в ДНК можно быстро определить с помощью специфического химического расщепления
Появление надежных методов определения последовательности нуклеотидов в молекулы ДНК облегчило также изучение структуры ДНК и ее связи с экспрессией гена. Метод химического расщепления, разработанный Алланом Максамом и Уолтером Гилбертом (Allan Maxam, Walter Gilbert), основан на использовании ДНК, меченной 32Р по одному из концов одной из цепей. Для введения 32Р в 5'-гидроксильный конец обычно используют поли- нуклеотидкиназу. Меченую ДНК расщепляют предпочтительно по одному из четырех нуклеотидов. Условия реакции подбирают таким образом, чтобы на каждую цепь приходился в среднем один разрыв.
Частичное расщепление по каждому основанию дает набор радиоактивных фрагментов, начинающихся 32Р-меткой и кончающихся одним из положений этого основания. Например, если исследуемая ДНК имеет последовательность 5'-32Р-GСТАСGТА-3' то в результате специфического расщепления с 5'-стороны каждого из четырех оснований получатся следующие радиоактивные фрагменты:

Затем эти фрагменты разделяют методом электрофореза в полиакриламидном геле, который дает возможность разделять молекулы ДНК, различающиеся по длине всего лишь на один нуклеотид. Следующий этап - радиоавтография этого геля. Как показано на рис. 24.50, самая нижняя полоса расположена на дорожке, соответствующей расщеплению по С, следующая - на дорожке Т, затем еще одна - на дорожке А. Следовательно, последовательность первых трех нуклеотидов имеет вид 5'-СТА-3'. Если прочитать все семь полос снизу-вверх, получится последовательность 5'-CTACGTA-3'. Итак, радиоавтограф геля, полученного после четырех различных реакций химического расщепления, дает набор полос, по которым можно непосредственно прочитать нужную последовательность.
Рис. 24.50. Схематическое изображение геля, на котором показаны радиоактивные фрагменты, образовавшиеся при специфическом расщеплении последовательности 5'-32Р-GСТАСGТА- 3' по каждому из четырех оснований (дорожки А, G, С и Т). Слева указано число нуклеотидов (n) в каждом фрагменте. Последовательность оснований читается непосредственно с геля снизу-вверх

Как достигается специфическое расщепление ДНК? Для этого используют соединения, которые способны модифицировать основание и затем отщеплять его от остатка сахара (рис. 24.51). Пурины модифицируют диметилсульфатом, метилирующим гуанин по N-7 и аденин по N-3. Расщепление гликозидной связи метилированного пурина легко достигается нагреванием при нейтральном значении рН.
Рис. 24.51. Стратегия метода определения последовательности нуклеотидов в ДНК с помощью химического расщепления
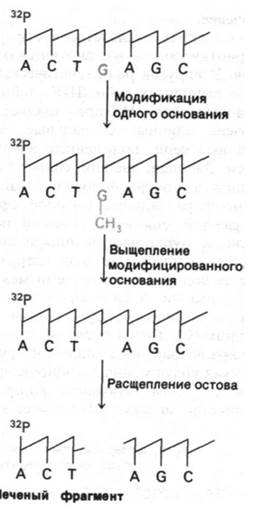
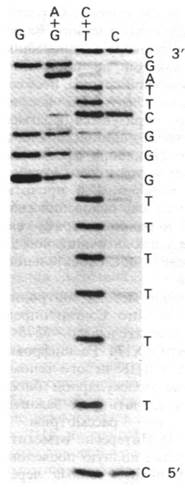
В результате основание отделяется от соответствующего остатка сахара. Затем смесь нагревают в щелочи, что вызывает расщепление сахарофосфатного остова ДНК и удаление остатка сахара. В результате образуются фрагменты, несущие на конце метку. Эти фрагменты разделяют в полиакриламидном геле и на радиоавтографе получают картину полосы различной интенсивности. Темные полосы соответствуют фрагментам, образовавшимся при расщеплении по гуанину, так как гуанин метилируется гораздо быстрее, чем аденин. В то же время гликозидная связь в метилированном аденозине менее стабильна, чем в метилированном гуанозине. Поэтому при обработке разбавленной кислотой после метилирования происходит предпочтительное выщепление аденина (получается дорожка А + G). Сравнение дорожки А + G с параллельной дорожкой G на том же геле показывает, происходит ли расщепление по А или по G (рис. 24.52). Расщепление по цитозину и тимину проводят гидразином. Остов затем расщепляют пиперидином, который вытесняет продукты реакции с гидразином и катализирует элиминацию фосфатов. В результате расщепления по цитозинам и тиминам получают серию полос примерно равной интенсивности (дорожка С + Т). Эти пиримидины различают, проводя гидразинолиз в присутствии 2 М NаСl, подавляющим реакцию с тимином (дорожка С). Теперь последовательность ДНК можно прочитать по радиоавтографу геля, сопоставляя дорожки G, А + G, С + Т и С (рис. 24.52). Самый короткий фрагмент имеет самую высокую электрофоретическую подвижность, так что 5'-концу соответствует низ геля. Если использовать несколько различных гелей для разделений всех меченых фрагментов, можно легко определить таким образом последовательности длиной более 150 пар оснований.
Рис. 24.52. На радиоавтографе геля видны меченые фрагменты, образовавшиеся при химическом расщеплении. 5'-конец этой ДНК был помечен 32Р. Самый короткий нуклеотид расположен у основания геля. С геля можно прочитать последовательность 5'-CTTTTTTGGGCTTAGC-3'
24.29. Полная последовательность оснований ДНК фага фХ174 была определена с помощью метода ферментативной репликации
Другой метод определения последовательности оснований в ДНК основан на образовании меченых фрагментов с помощью контролируемого прерывания ферментативной репликации in vitro. Этот метод разработали Фред Сэнгер (Fred Sanger) и его сотрудники. Для считывания определенной последовательности с одноцепочечной ДНК используют ДНК-полимеразу
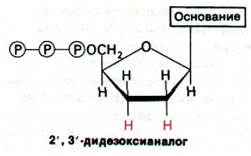
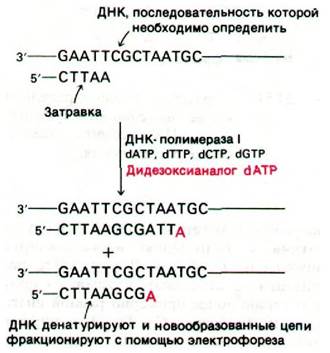
I1). В качестве затравки для синтеза используется комплементарный фрагмент, который можно получить из набора продуктов рестрикции, соответствующей двухцепочечной ДНК. Кроме четырех радиоактивных дезоксирибонуклеозидтрифосфатов, инкубационная смесь содержит 2',3'-дидезоксианалог одного из них. Включение этого аналога блокирует дальнейший рост цепи, так как он не содержит концевой 3'-гидроксильной группы, необходимой для образования следующей фосфодиэфирной связи. Так образуются фрагменты, несущие на 3'-конце дидезоксианалог (рис. 24.53). Затем четыре набора фрагментов, образованных терминированием цепей, разделяют гель-электрофорезом и прочитывают последовательность оснований синтезированной ДНК по радиоавтографу геля. Используя менее 1 пмоль очищенной ДНК, можно определить последовательности 200 нуклеотидов.
Рис. 24.53. Стратегия метода определения последовательности нуклеотидов в ДНК путем терминирования цепи. Фрагменты образуются в результате добавления 2',3'-дидезоксианалога одного из dNTP в каждую из четырех пробирок, в которых происходит полимеризация. Например, при добавлении дидезоксианалога dATP образуются фрагменты, оканчивающиеся на А (показано красным цветом)
С помощью метода контролируемой репликации in vitro Сэнгер определил полную последовательность 5375 оснований в ДНК фага ɸХ174. Расшифровка последовательности ДНК целого генома - крупное достижение молекулярной биологии. Она позволила сделать ряд важных выводов, которые мы рассмотрим в гл. 26 (разд. 26.11). Интересно отметить, что Сэнгер определил полную последовательность оснований целого генома через четверть века после того, как он расшифровал аминокислотную последовательность белка 2.
1 Поэтому данный метод в отечественной литературе называют методом полимеразного копирования. Прим. перев.
2 Следует отметить, что в промежутке между этими открытиями Ф. Сэнгер разработал оригинальный метод определения последовательности оснований в РНК, который имел огромные преимущества перед другими известными в то время методами. Прим. перев.