БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
Мембраны многих клеток способны возбуждаться под действием специфических химических или физических стимулов. Ответы мембраны аксона нервной клетки на электрический стимул, синапса на выделение медиатора, палочек сетчатки на свет, подвижных клеток на молекулы аттрактантов - все это реакции, опосредованные возбудимыми комплексами, присутствующими в мембранах. Эти и другие процессы, опосредованные возбудимыми комплексами, имеют следующие общие особенности.
1. Стимул воспринимается высокоспецифичным белком-рецептором, который является интегральным компонентом возбудимой мембраны.
2. Специфический стимул вызывает изменение конформации рецептора, что в свою очередь приводит к изменению проницаемости мембраны или активности связанного с мембраной фермента. При этом во многих случаях происходит многократное усиление ответа на специфические стимулы.
3. Как конформационный сдвиг, так и возникающие в результате функциональные изменения рецептора обратимы. Существуют специальные механизмы, возвращающие рецептор в состояние покоя и восстанавливающие его возбудимость.
В этой главе мы рассмотрим четыре типа возбудимых комплексов, начав с натриевого канала в мембранах аксонов нервных клеток; этот зависимый от потенциала канал участвует в возникновении потенциала действия в нервах. Далее мы обратимся к химически регулируемому каналу и рассмотрим, как рецепторы ацетилхолина обеспечивают проведение нервного импульса в определенных синапсах. Затем перейдем к палочкам сетчатки глаза - исключительно чувствительному детектору света. При этом мы познакомимся с ролью фоторецепторного белка родопсина в преобразовании света в нервный сигнал. Последняя тема данной главы - хемотаксис, т. е. движение клеток по направлению к веществам-аттрактантам и от веществ-репеллентов. В последние годы получено много новых сведений относительно сопряжения хеморецепторов с двигательным аппаратом у бактерий.
37.1. Потенциалы действия опосредованы кратковременными изменениями проницаемости для Na+ и К+
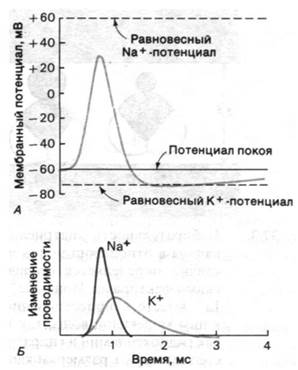
Нервные импульсы представляют собой электрические сигналы, создаваемые током ионов через плазматическую мембрану нейронов. В нейроне, как и в большинстве клеток, К+содержится в высокой концентрации, a Na+ - в низкой. Градиенты концентрации этих ионов генерируются (Na+ + К+)-насосом (разд. 36.2). В состоянии покоя проницаемость мембраны нервной клетки для К+ гораздо выше, чем проницаемость для Na+, и поэтому мембранный потенциал определяется главным образом отношением внутриклеточной концентрации К+ к внеклеточной (рис. 37.2, А). В нестимулированных аксонах мембранный потенциал составляет -60 мВ; это близко к величине -75 мВ (равновесный К+-потенциал), которая соответствует проницаемости мембраны для одних только ионов К+. Нервный импульс, или потенциал действия, возникает при деполяризации мембраны, выходящей за пределы выше порогового уровня (а именно с —60 до —40 мВ). За несколько миллисекунд мембранный потенциал становится положительным и достигает примерно +30 мВ, после чего вновь делается отрицательным. Эта усиленная в несколько раз деполяризация распространяется по нерву, достигая нервного окончания. В раскрытии природы потенциала действия важную роль сыграло изучение гигантского аксона кальмара. Поскольку в этот необычайно крупный аксон (диаметром около миллиметра) нетрудно ввести электроды, он стал излюбленным объектом исследователей.
Рис. 37.1. Электронная микрофотография синапса
Каков механизм возникновения потенциала действия? Ален Ходжкин и Эндрью Хаксли (Alan Hodgkin, Andrew Huxley) провели остроумные исследования, показавшие, что потенциал действия возникает в результате сильных кратковременных изменений проницаемости мембраны аксона для ионов Na+ и К (рис. 37.2, Б). Сначала меняется проницаемость мембраны для Na+. Деполяризация мембраны выше порогового уровня приводит к открытию Na+-каналов. В силу существования высокого трансмембранного электрохимического градиента концентрации Na+ ионы натрия начинают входить в клетку. Вход Na+ усиливает деполяризацию мембраны и способствует тому, что открывается еще большее число Na+-каналов. Эта положительная обратная связь между деполяризацией и входом Na+ приводит к очень быстрым и очень большим по величине изменениям мембранного потенциала: от —60 до +30 мВ за одну миллисекунду. Вход прекращается при достижении примерно +30 мВ, так как это значение соответствует равновесному Na+-потенциалу. Другими словами, по достижении этого потенциала исчезает та термодинамическая движущая сила, за счет которой происходил вход Nа+. Nа+-каналы спонтанно закрываются, и к этому времени начинают открываться К+-каналы (рис. 37.2, Б). В результате ионы калия входят в клетку, и мембранный потенциал вновь становится отрицательным. Примерно через две миллисекунды мембранный потенциал становится равным —75 мВ, т. е. равновесному K+-потенциалу. Уровень покоя —60 мВ восстанавливается еще через несколько миллисекунд, когда проводимость К+ снижается до величины, характеризующей нестимулированное состояние. Необходимо подчеркнуть, что во время потенциала действия через плазматическую мембрану проходит очень малое количество ионов Nа+ и К+ - примерно одна миллионная часть от содержания этих ионов в нервной клетке. Другими словами, при одном нервном импульсе расходуется лишь ничтожно малая часть (Nа+-К+)-градиента. Из этого явствует, насколько эффективен потенциал действия как средство сигнализации на большие расстояния.
Рис. 37.2. Потенциал действия возникает в результате деполяризации мембраны аксона нервной клетки. Показано изменение во времени мембранного потенциала (А) и проводимости ионов натрия и калия (Б)
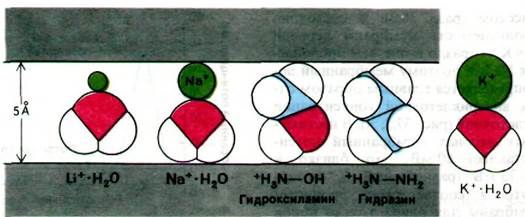
Na+-канал проводит Na+ в 11 раз лучше, чем К+. Как достигается такая избирательность? Окончательный ответ на этот вопрос будет получен только после анализа структуры канала при высоком разрешении. Однако электрофизиологические исследования относительной проницаемости канала для различных щелочных катионов и органических катионов все же дают определенный ключ к решению данного вопроса. Зависимость проницаемости от размера иона (табл. 37.1) указывает на то, что канал узок: через него не проходят ионы, диаметр которых превышает 5 А. Однако проводимость определяется не только размерами. Так, метиламин (H3CNH3+) имеет почти такие же размеры, как гидразин (H2NNH3+) и гидроксиламин (HONH3+), но при этом несравненно хуже проходит через канал. Причина, по всей вероятности, кроется в том, что метильная группа метиламина в отличие от аминогруппы гидразина или гидроксильной группы гидроксиламина не образует водородной связи с кислородным атомом канала. В результате метиламин не проходит по каналу. Обнаружен еще один важный факт: проводимость Na+-канала в отношении всех проникающих катионов значительно уменьшается при снижении рН. По существу, относительная проницаемость соответствует кривой титрования кислоты с рK 5,2, что указывает на присутствие отрицательно заряженного карбоксилат-иона в активной форме канала. Таким образом, избирательность Nа+-канала в отношении Na+ обусловлена наличием отрицательно заряженного участка с малым радиусом. Ион К+, будучи крупнее, чем Na+, практически не может пройти через эту область (рис. 37.3).
Таблица 37.1. Относительная проницаемость натриевого и калиевого каналов в мембранах аксонов
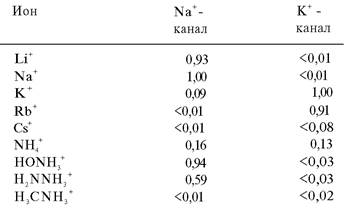
Рис. 37.3. Избирательность натриевого канала в отношении ионов частично определяется стерическими факторами. Ионы Na+ и Li+ вместе с присоединенной к ним молекулой воды, так же как гидроксиламин и гидразин, соответствуют размерам канала. В отличие от этого К+ с присоединенной молекулой воды оказывается слишком большим для канала