БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
37.5. Ацетилхолин высвобождается квантами
Проведенное Бернардом Катцем (Bernard Katz) изучение передачи нервного импульса в участках нервно-мышечного соединения показало, что ацетилхолин высвобождается из пресинаптической мембраны порциями по 104 молекул. Доказательство квантового высвобождения ацетилхолина было получено при анализе мембранного потенциала двигательных концевых пластинок, которым свойственна спонтанная электрическая активность даже в отсутствие стимуляции нерва. Деполяризующие импульсы с амплитудой 0,5 мВ и длительность около 20 мс возникают залпами. Это так называемые миниатюрные потенциалы концевых пластинок; они возникают случайно с вероятностью, сохраняющейся постоянной на протяжении длительного времени. Миниатюрный потенциал концевой пластинки вызывается спонтанным высвобождением одиночного синаптического пузырька. Полная деполяризация концевой пластинки, создаваемая потенциалом действия, обусловлена синхронным высвобождением примерно 100 «квантов» («пакетов») ацетилхолина за более короткое время чем 1 мс. Число высвобождающихся квантов ацетилхолина зависит от потенциала действия пресинаптической мембраны. Другими словами, высвобождение ацетилхолина представляет собой электрически регулируемую форму секреции. Высвобождение ацетилхолина зависит от присутствия Са2+ во внеклеточной жидкости. При деполяризации пресинаптической мембраны происходит вход Са2+,
что способствует слиянию на короткий срок мембраны синаптических пузырьков с пресинаптической мембраной.
37.6. При добавлении ацетилхолина реконструированные мембранные пузырьки становятся проницаемыми для катионов
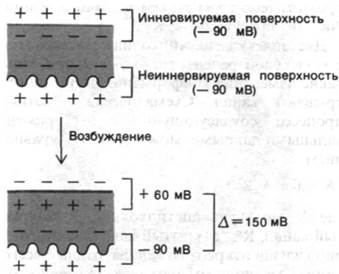
В последние годы сделаны большие успехи в очистке ацетилхолиновых рецепторов и реконструировании функционально активных мембранных пузырьков. Наиболее подходящий исходный материал для таких исследований - электрический орган электрической рыбы, например, Torpedo (электрический скат), который очень богат холинергическими постсинаптическими мембранами. Электрический орган образован из колонок клеток, называемых электрическими пластинками. Одна сторона клеток (иннервируемая поверхность) снабжена нервными окончаниями и электрически возбудима. Другая сторона (неиннервируемая поверхность) образует многочисленные складки и электрически невозбудима. Разность потенциалов, возникающая при стимуляции электрических пластинок, обусловлена асимметрией ответа двух поверхностей. У такой электрической рыбы, как Electropho- rus, мембранный потенциал иннервируемой поверхности при возбуждении сдвигается с —90 до +60 мВ, тогда как на неиннервируемой поверхности сохраняется —90 мВ. Следовательно, в пик потенциала действия разность потенциалов между наружными поверхностями двух сторон составляет 150 мВ (рис. 37.8). Электрические пластинки электрического органа соединены параллельно, и, следовательно, их разность потенциалов складывается. Орган, состоящий из 5000 рядов электрических пластинок, может, таким образом, генерировать разряд в 750 В. Интересно отметить, что электрические пластинки электрического угря эволюционно возникли из мышечных клеток. При этом они сохранили электрически возбудимую наружную мембрану мышцы, но утратили аппарат сокращения. Электрический орган Electrophorus - великолепный источник Na+-каналов.
Electrophorus electricus, американский электрический угорь

Рис. 37.8. Генерирование напряжения в электрической пластинке электрического угря
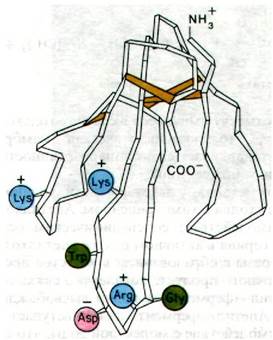
Еще один экзотический биологический материал оказался бесценным источником ацетилхолиновых рецепторов. Для того, чтобы идентифицировать рецептор в смеси макромолекул, его необходимо специфически пометить. Для этого используют нейротоксины змей, в частности α-бунгаротоксин из яда одной змеи с о. Тайвань и кобратоксин (из яда кобры). Указанные нейротоксины блокируют нейромышечное проведение, связываясь с рецепторами ацетилхолина на двигательных концевых пла
стинках или на иннервируемой поверхности электрических пластинок электрического органа. Нейротоксины представляют собой небольшие основные белки (7 кДа). Их можно пометить радиоактивным изотопом с высокой удельной радиоактивностью. Для этого их либо иодируют иодом-125, либо превращают в шиффово основание с пири- доксальфосфатом с последующим восстановлением образованного продукта 3М-боргидридом. Меченый кобратоксин прочно связывается с ацетилхолиновым рецептором (константа диссоциации - порядка 10-9 М) и, что особенно важно, практически не связывается с другими макромолекулами постсинаптической мембраны. Таким образом, рецептор ацетилхолина можно специфически пометить радиоактивным атомом.
Рис. 37.9. Трехмерная структура нейротоксина, блокирующего рецептор ацетилхолина. Этот нейротоксин вырабатывается у морских змей
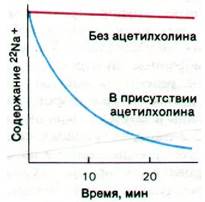
Путем обработки фрагментов мембраны неионным детергентом (таким, как производное полиоксиэтилена твин-80) удалось солюбилизировать рецепторы ацетилхолина электрического органа. Полученный раствор фракционировали методами гель- фильтрации и ионообменной хроматографии. Последним этапом очистки была аффинная хроматография на колонке, содержащей ковалентно связанный кобратоксин. В итоге был получен рецептор, очищенный в 10000 раз. Ацетилхолиновый рецептор представляет собой комплекс массой 270 кДа, состоящий из четырех типов субъединиц. Субъединица 40 кДа метится по сродству радиоактивными соединениями, содержащими группу триметиламмония, что указывает на наличие в ней участка связывания ацетилхолина. Удалось получить мембранные пузырьки, содержащие очищенные рецепторы ацетилхолина; для этого к раствору рецепторов добавляли фосфолипиды и затем удаляли диализом детергент. Показано, что радиоактивные ионы натрия (22Nа+), включенные в процессе реконструирования пузырьков в их внутреннее водное пространство, высвобождаются при добавлении ацетилхолина или его аналогов, например, карбамоилхолина (рис. 37.10). Высвобождение ионов натрия блокируют бунгаротоксин и обычные антагонисты ацетилхолина; следовательно, оно опосредовано специфическим взаимодействием ацетилхолина со связанным с мембраной рецептором.
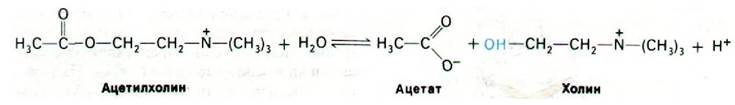
Рис. 37.10. Ацетилхолин вызывает высвобождение Na+ из реконструированных мембранных пузырьков, содержащих ацетилхолиновый рецептор. По оси ординат отложено содержание 22Nа+ в синаптических пузырьках
37.7. Ацетилхолин быстро гидролизуется, и концевая пластинка реполяризуется
Для восстановления возбудимости постсинаптической мембраны необходимо выключение деполяризующего сигнала. Эту функцию выполняет ацетилхолинэстераза, открытая Дэвидом Нахманзоном (David Nachmansohn) в 1938 г. Фермент гидролизует ацетилхолин до ацетата и холина. В результате проницаемость постсинаптической мембраны возвращается к исходному уровню и мембрана реполяризуется. Ацетилхолинэстераза локализована в синаптической щели, где она связана с сетью из коллагена и гликозамингликанов, поступающих из постсинаптической клетки. Масса фермента 260 кДа, субъединичная структура - α2β2. Ацетилхолинэстеразу можно легко отделить от ацетилхолиновых рецепторов. Фермент характеризуется поразительно высоким числом оборотов, а именно 25000 с-1. Это означает, что одна молекула ацетилхолина расщепляется за 40 мкс. Такое высокое число оборотов фермента имеет очень важное значение для быстрого восстановления поляризованного состояния постсинаптической мембраны. Синапсы способны передавать тысячу импульсов в секунду только потому, что постсинаптическая мембрана восстанавливает свою поляризованность за доли миллисекунды.
Рис. 37.11. Электронная микрофотография ацетилхолиновых рецепторов в постсинаптической мембране

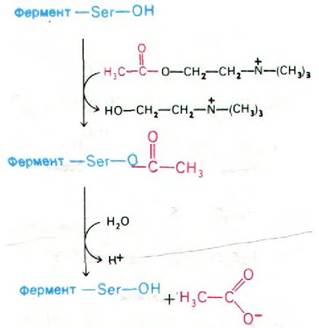
По механизму действия ацетилхолинэстераза сходна с химотрипсином. Ацетилхолин взаимодействует со специфическим остатком серина в активном центре ацетилхолинэстеразы с образованием в качестве промежуточного продукта ковалентно связанного ацетил-фермента, а холин высвобождается. Ацетил—фермент далее вступает во взаимодействие с молекулой воды, что приводит к образованию ацетата и регенерированного свободного фермента (рис. 37.12).
Рис. 37.12. Механизм каталитического действия ацетилхолинэстеразы