БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 25. ИНФОРМАЦИЯ РНК И ТРАНСКРИПЦИЯ
25.18. Антибиотики - ингибиторы транскрипции: рифамицин и актиномицин
Антибиотики - очень интересные молекулы, так как многие из них представляют собой весьма специфические ингибиторы биологических процессов. Актиномицин и рифамицин - два антибиотика, ингибирующих транскрипцию совершенно различным путем. Рифамицин, образуемый бактериями Streptomyces, и его полусинтетическое производное рифампицин специфически ингибируют инициацию синтеза РНК. Эти антибиотики не предотвращают связывания РНК-полимеразы с ДНК-матрицей. Рифампицин препятствует образованию первой фосфодиэфирной связи в цепи РНК. При этом антибиотик практически не влияет на элонгацию цепи. Столь высокая избирательность ингибирующего действия делает рифампицин ценным инструментом в молекулярно-биологических исследованиях. Например, его можно использовать для подавления инициации новых цепей РНК, не затрагивая транскрипции тех цепей, синтез которых уже начался. Мишенью для рифампицина, видимо, служит β-субъединица РНК-полимеразы. Были выделены мутанты Е. coli, устойчивые к рифампицину (так называемые rif-r-мутанты). В некоторых из них электрофоретическая подвижность ß-субъединицы изменена.
Рис. 25.21. Пространственная модель структуры актиномицина D. Феноксазоновое кольцо обозначено красным цветом, циклические пептиды - желтым
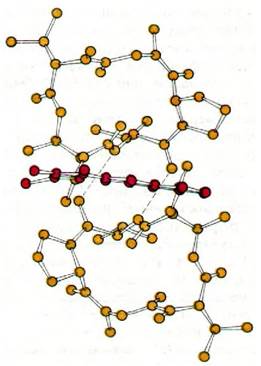
Механизм действия актиномицина D (содержащего полипептиды антибиотика, продуцируемого микроорганизмом Streptomyces) совершенно отличен от механизма действия рифампицина. Актиномицин D прочно связывается с двухспиральной ДНК и за счет этого подавляет ее активность в качестве матрицы для синтеза РНК. Он состоит из двух идентичных циклических пептидов, соединенных феноксазоновой системой колец (рис. 25.22). Состав этих циклических пептидов необычен: они содержат саркозин, метилвалин и D-валин. Кроме того, в их молекуле имеется эфирная связь между гидроксильной группой треонина и карбоксильной группой метилвалина.
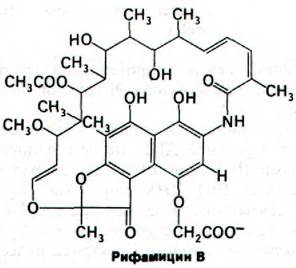
Рис. 25.22. Структура актиномицина D
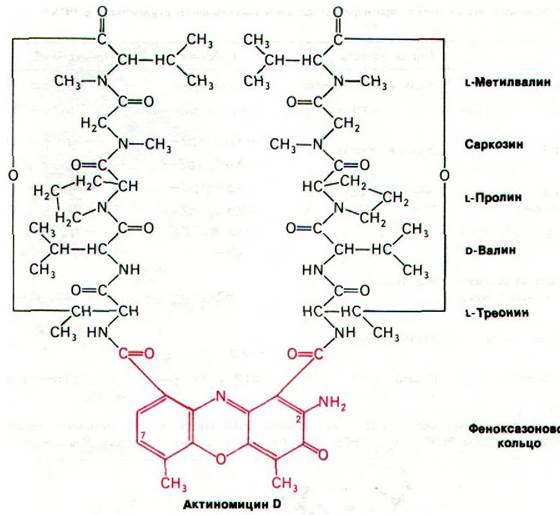
Актиномицин D прочно связывается с двухспиральной ДНК, но не с одноцепочечными ДНК или РНК, двухспиральной РНК или РНК-ДНК-гибридами. Кроме того, связывание актиномицина с ДНК заметно усиливается с увеличением содержания остатков гуанина. Спектроскопические и гидродинамические исследования комплексов актиномицина D с ДНК свидетельствуют о том, что феноксазоновое кольцо актиномицина проникает в ДНК между двумя соседними парами оснований. Такой способ связывания называется интеркаляцией (рис. 25.23). При низких концентрациях актиномицин D ингибирует транскрипцию, не оказывая сколько-нибудь существенного влияния на репликацию ДНК. На синтез белка непосредственно актиномицин также не влияет. Благодаря этому актиномицин D широко использовался в качестве специфического ингибитора образования новых РНК как в прокариотических, так и в эукариотических клетках.
Рис. 25.23. Предполагаемая структура комплекса актиномицина D с ДНК. Феноксазоновое кольцо актиномицина (показано красным цветом) интеркалирует между двумя GС-парами ДНК (показаны синим цветом). Циклические пептиды актиномицина D (желтые) связываются с малой бороздкой спирали ДНК. Между актиномицином D и соседними гуанинами возникает несколько водородных связей. Ось симметрии субъединиц актиномицина D совпадает с осью симметрии сахарофосфатного остова и последовательности оснований ДНК
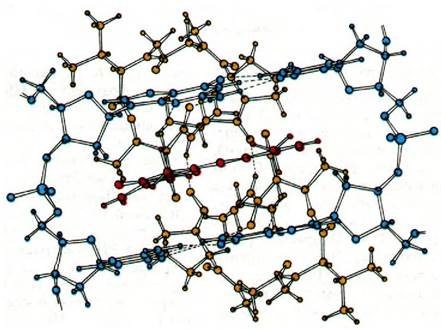
Недавно структура кристаллического комплекса одной молекулы актиномицина с двумя молекулами дезоксигуанозина была изучена на уровне атомного разрешения (рис. 25.23). В этом комплексе феноксазо- новое кольцо актиномицина зажато между двумя гуаниновыми кольцами. Один из циклических пептидов расположен над фе- ноксазоновым кольцом, другой - под ним. Каждый из этих пептидов образует сильные водородные связи с 2-аминогруппой гуанинового остатка. Между антибиотиком и нуклеозидами осуществляется много энергетически выгодных вандерваальсовых взаимодействий. Важная особенность этого комплекса состоит в том, что он почти симметричен. Ось симметрии второго порядка проходит вдоль линии, соединяющей средние атомы О и N феноксазонового кольца. Конформация всего комплекса показывает, что актиномицин узнает в ДНК последовательность оснований GpC. Обратите внимание, что если в одной цепи ДНК имеется последовательность 5'GpC3', то в комплементарной цепи последовательность будет 3'CpG5'. По-видимому, актиномицин интеркалирует в ДНК между двумя GC-парами оснований и взаимодействует с остатками G в основном таким же образом, как и в комплексе с динуклеотидом. Согласно этой модели, циклические пептидные остатки локализованы в малой бороздке спирали ДНК. Главная особенность этой модели состоит в том, что симметрия молекулы актиномицина соответствует симметрии определенной последовательности в ДНК.
25.19. Разработаны совершенные методы определения последовательности нуклеотидов в РНК
Высокая разрешающая способность метода гель-электрофореза дает возможность быстро определять последовательности нуклеотидов как в молекулах РНК, так и
в молекулах ДНК. Для этого 3'- или 5'-конец цепи РНК метят радиоактивной группой. Затем меченую цепь частично расщепляют по одному из четырех оснований, чтобы получить набор фрагментов. Специфическое (или избирательное) расщепление можно провести с помощью ферментов, специфичных к определенному основанию эндонуклеаз (табл. 25.4). Например, рибонуклеаза Т1 гидролизует РНК с 3'-стороны остатков G. Кроме того, РНК можно специфически расщепить с помощью химической модификации одного из четырех оснований. Затем остов расщепляют в месте, где расположено модифицированное основание. После этого четыре набора фрагментов разделяют гель-электрофорезом и последовательность оснований РНК читают непосредственно с радиоавтографа (рис. 25.24), как и в случае ДНК (разд. 24.28). Эти подходы позволяют легко определять в молекулах РНК последовательность 100-200 нуклеотидов.
Рис. 25.24. Радиоавтограф фрагмента 5S-PHK дрожжей. 3'-конец помечен радиоактивной меткой. Четыре дорожки соответствуют расщеплению по остаткам G, А, С и U. На геле можно прочитать последовательность 5'-CGAAACUCAGGUGCUG- CAAUC-3'
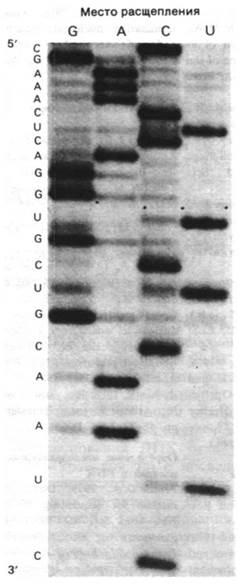
Таблица 25.4. Ферменты, используемые при определении последовательности нуклеотидов в РНК1

1 Изложенная точка зрения на структуру комплекса актиномицина D с ДНК не является общепризнанной. Существует и другая гипотеза, согласно которой актиномицин не интеркалирует в ДНК, а связывается в малой бороздке, причем структура комплекса актиномицина D с динуклеотидом GpC не отражает структуры его комплексов с протяженными молекулами ДНК. - Прим. перев.
Другая стратегия сводится к тому, чтобы определять последовательность нуклеотидов не в самой РНК, а в комплементарной ДНК. Но как получить комплементарные фрагменты ДНК? Один из методов состоит в следующем. С помощью рестрикционных эндонуклеаз фрагментируют большие молекулы ДНК. Затем методом гибридизации идентифицируют рестрикционные фрагменты, содержащие последовательность, комплементарную исследуемой РНК. В другом случае комплементарную ДНК синтезируют ферментативно по РНК-матрице с помощью обратной транскриптазы из опухолеродных вирусов (разд. 30.19). Именно так была расшифрована полная последовательность 576 нуклеотидов мРНК, колирующей β-цепь гемоглобина человека.