БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 27. СИНТЕЗ БЕЛКА
Из предыдущей главы нам известно, что последовательность аминокислот в белках определяется последовательностью кодонов в мРНК, считываемых молекулами тРНК. Обратимся теперь к механизму синтеза белка. Этот процесс называется трансляцией (от англ. translation - перевод), так как информация, записанная на четырехбуквенном языке нуклеиновых кислот, переводится на язык белков, состоящий из 20 букв. Как и следовало ожидать, трансляция - процесс более сложный, чем репликация или транскрипция ДНК, которые происходят с использованием одного и того же языка спаривания оснований. Трансляция осуществляется в результате согласованного взаимодействия более чем сотни видов макромолекул. Помимо рибосом, необходимы молекулы тРНК, активирующих ферментов, растворимых факторов и мРНК.
Прежде чем перейти к подробному описанию синтеза белка, рассмотрим процесс в общих чертах. Белок синтезируется в направлении от аминоконца к карбоксильному концу путем последовательного присоединения аминокислот к карбоксильному концу растущей пептидной цепи. Амино- ацил-тРНК, в которых карбоксильная группа аминокислоты присоединена к 3'-концу тРНК, играют в этом процессе роль активированных предшественников. Присоединение аминокислоты к соответствующей тРНК катализирует аминоацил- тРНК—синтетаза. Эта реакция активации, будучи аналогична активации жирных кислот, также запускается энергией гидролиза АТР. Для каждой аминокислоты имеется по крайней мере один вид тРНК и специфический активирующий фермент. Синтез белка осуществляется в три стадии, называемые инициацией, элонгацией и терминацией.
Инициация приводит к связыванию инициа- торной тРНК с сигналом начала транскрипции в мНРК. Инициаторная тРНК занимает Р-участок рибосомы (от англ. peptidyl - пептидильный) - один из двух участков связывания тРНК. Элонгация начинается со связывания аминоацил-тРНК с другим участком связывания тРНК на рибосоме, называемым А-участком (от англ. aminoacyl - аминоацильный). Затем образуется пептидная связь между аминогруппой второй аминоацил-тРНК и карбоксильной группой fMet, связанного с инициаторной тРНК. Теперь образовавшаяся в результате дипептидил-тРНК перемещается из А-участка в Р-участок, в то время как освободившаяся молекула тРНК покидает рибосому. Связывание аминоацил-тРНК, перемещение пептидил-тРНК из А-участка в Р-участок и одновременное перемещение рибосомы к следующему кодону мРНК требуют гидролиза GТР. Затем новая амино- ацил-тРНК связывается со свободным А- участком и начинается новый цикл реакции элонгации, подобный уже описанному. Терминация происходит тогда, когда стопкодон (сигнал терминации) в молекуле тРНК считывается фактором освобождения белка. Это приводит к отделению завершенной полипептидной цепи от рибосомы. В настоящей главе мы будем говорить главным образом о синтезе белка в клетках E. coli, где этот процесс лучше всего изучен. Некоторые различия между синтезом белка у прокариот и эукариот будут рассмотрены в разд. 29.25.
27.1. Аминокислоты активируются и присоединяются к транспортным РНК под действием специфических синтетаз
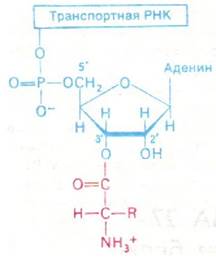
Образование пептидной связи между аминогруппой одной аминокислоты и СООН- группой другой аминокислоты термодинамически невыгодно. Этот термодинамический барьер преодолевается путем активации СООН-группы аминокислот-предшественников. Активированными промежуточными продуктами синтеза белка служат эфиры аминокислот, в которых карбоксильная группа аминокислоты связана с 2'- или 3'-гидроксильной группой рибозного остатка на 3'-конце тРНК. Аминоацильная группа может быстро перемещаться из 2'-положения в 3'-положение и обратно. Этот активированный промежуточный продукт называется аминоацил-тРНК (рис. 27.1).
Рис. 27.1. В аминоацил-тРНК аминокислота связана эфирной связью с 2'- или 3'-гидроксильной группой концевого аденозина
Присоединение аминокислоты к тРНК имеет значение не только потому, что при этом активируется ее карбоксильная группа и она может образовать пептидную связь, но и потому, что аминокислоты сами по себе не способны узнавать кодоны в мРНК. Аминокислоты переносятся к рибосомам специфическими тРНК, которые и узнают кодоны в мРНК. Таким образом, эти тРНК выполняют роль адапторных молекул.
В 1957 г. Пол Замечник и Малон Хогланд (Paul Zamecnik, Mahlon Hoagland) установили, что активация аминокислот и их последующее присоединение к тРНК катализируютсяспецифическими аминоацил-тРНК—синтетазами, которые также называют активирующимиферментами.
В реакциях, катализируемых некоторыми синтетазами, первая стадия состоит в образовании аминоациладенилата из аминокислоты и АТР. Это активированное соединение представляет собой смешанный ангидрид, в котором карбоксильная группа аминокислоты присоединена к фосфатной группе AMP. Другие синтетазы катализируют реакцию АТР, аминокислоты и тРНК без промежуточного образования доступного для обнаружения аминоациладенилата.
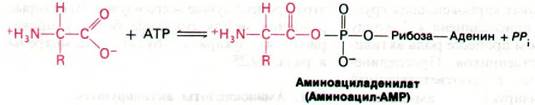
Следующий этап - перенос аминоацильной группы аминоацил-АМР на молекулу тРНК с образованием аминоацил-тРНК- активированного промежуточного продукта в синтезе белка. Переносится ли аминоацильная группа на 2'- или 3'-гидроксильную группу рибозного остатка на 3'-конце тРНК, зависит от того, о какой аминокислоте и какой аминоацил-тРНК—синтетазе идет речь. Активированная аминокислота может очень быстро перемещаться из 2'- в 3'-положение и обратно.
Аминоацил-АМР + тРНК - Аминоацил-тРНК + AMP.
Суммарная реакция этапов активации и переноса описывается следующим уравнением:
Аминокислота + АТР + тРНК ⇄ Аминоацил-тРНК + АМР + PPi.
∆G' для этой реакции близко к нулю, так как свободная энергия гидролиза эфирной связи аминоацил-тРНК соответствует свободной энергии гидролиза концевой фосфо-
рильной группы АТР. Что же в таком случае запускает синтез аминоацил-тРНК? Как и можно было ожидать, реакция запускается гидролизом пирофосфата. Суммарная реакция этих превращений высокоэкзергонична:
Аминокислота + АТР + тРНК + Н2O ⇄ Аминоацил-тРНК + АМР + 2Рi.
Таким образом, на синтез аминоацил- тРНК затрачиваются две богатые энергией фосфатные связи. Одна из них расходуется на образование эфирной связи аминоацил- тРНК, другая сдвигает равновесие реакции в сторону образования продукта.
Стадии активации и переноса определенной аминокислоты катализируются одной и той же аминоацил-тРНК—синтетазой. В действительности аминоацил-АМР не диссоциирует из комплекса с синтетазой. Он прочно связывается с активным центром фермента нековалентными взаимодействиями. В норме аминоацил-АМР, образующийся в качестве промежуточного продукта синтеза аминоацил-тРНК, существует в течение непродолжительного времени, но он вполне стабилен и может быть легко выделен, если в реакционной смеси нет тРНК.
Мы уже встречались с ациладенилатным промежуточным продуктом при активации жирных кислот (разд. 17.6). Интересно отметить, что Пол Берг (Paul Berg) первым открыл этот промежуточный продукт в реакции активации жирных кислот, и он же позже выяснил, что этот продукт образуется также при активации аминокислот. Основное различие между этими реакциями состоит в том, что в первом случае роль акцептора ацильных групп играет СоА, а во втором - тРНК. Энергетика этих биосинтетических реакций очень сходна: обе они становятся необратимыми благодаря гидролизу неорганического пирофосфата.
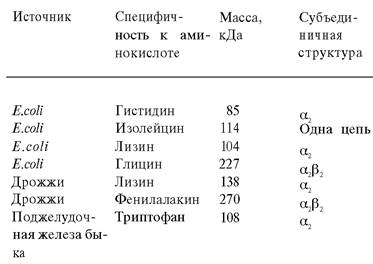
Для каждой аминокислоты имеется по крайней мере одна аминоацил-тРНК—синтетаза. Эти ферменты различаются по размеру, субъединичной структуре и аминокислотному составу (табл. 27.1).
Таблица 27.1. Свойства некоторых аминоацнл- тРНК-сннтетаз