БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 27. СИНТЕЗ БЕЛКА
27.2. Надежность синтеза белка определяется высокой специфичностью аминоацил-тРНК-синтетаз
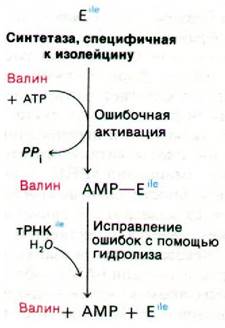
Правильная трансляция генетических матриц обеспечивается высокой специфичностью аминоацил-тРНК—синтетаз. Эти ферменты весьма избирательны в отношении активируемых аминокислот и соответствующей тРНК-акцептора. Как будет указано несколько ниже, молекулы тРНК, акцептирующие различные аминокислоты, имеют различные последовательности оснований, благодаря чему синтетазы легко узнают их. Гораздо более сложная задача для этих ферментов - различать сходные аминокислоты. Например, единственное различие между изолейцином и валином состоит в том, что изолейцин содержит лишнюю метиленовую группу (рис. 27.2). Дополнительная энергия связывания, которую вносит эта лишняя группа —СН2—, благоприятствует тому, что активация изолейцина происходит примерно в 200 раз чаще, чем активация валина. Концентрация валина in vivoпримерно в 5 раз выше концентрации изолейцина, так что валин должен был бы неправильно включаться вместо изолейцина в одном случае из 40. Однако наблюдаемая частота ошибок in vivo составляет всего одну на 3000. Это указывает, что должна существовать еще какая-то стадия коррекции ошибок для увеличения надежности. Действительно, синтетаза исправляет собственные ошибки. Валин, активированный по ошибке, не переносится на тРНК, специфичную к изолейцину. Вместо этого тРНК способствует гидролизу валин-АМР и таким образом предупреждает его неправильное включение в белки. Кроме того, эта гидролитическая реакция освобождает синтетазу для активации и переноса изолейцина правильной аминокислоты. Каким образом синтетаза избегает гидролиза изолейцин-АМР - правильного промежуточного продукта? Скорее всего, гидролитический участок достаточно велик, чтобы там поместился валин-АМР, но слишком мал для связывания изолейцин-АМР.
Рис. 27.2. Пространственные модели валина и изолейцина. Синте- тазы, активные в отношении этих аминокислот, высоко специфичны
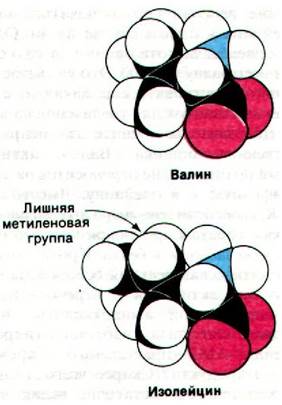
Рис. 27.3. Исправление ошибок с помощью гидролиза ошибочного продукта
Многие другие аминоацил-тРНК—синтетазы также содержат, помимо участков синтеза, гидролитические участки. Возможно, эти участки действуют как двойные фильтры, обеспечивающие высокую надежность. Участок синтеза отбрасывает аминокислоты, превышающие по размеру нужную аминокислоту, а гидролитический участок разрушает те активированные промежуточные продукты, которые меньше по размеру, чем требуется. Очевидно, высокая надежность синтеза белка в первую очередь зависит от механизма коррекции с помощью гидролитической активности, которой обладают многие аминоацил-тРНК—синтетазы.
27.3. Молекулы транспортных РНК имеют общий план строения
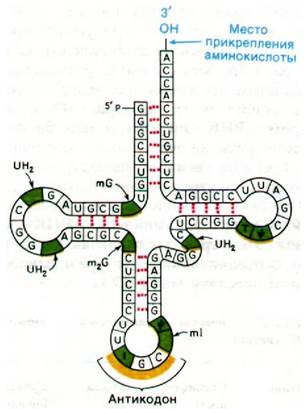
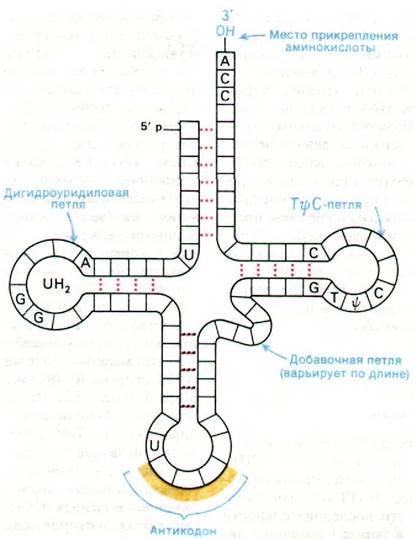
В 1965 г, Роберт Холли (Robert Holley) после семи лет упорных поисков впервые определил последовательность оснований одной из транспортных РНК. При исследовании дрожжевой аланиновой тРНК была получена первая полная последовательность нуклеиновой кислоты. Эта работа стала источником новых идей, касающихся биологической активности молекулы тРНК. В процессе расшифровки последовательности Холли разработал общие методы для определения последовательности нуклеотидов в нуклеиновых кислотах. Последовательность дрожжевой аланиновой тРНК показана на рис. 27.4. Молекула представляет собой одну цепь из 76 рибонуклеотидов. 5'-конец фосфорилирован (рG), а З'-конец имеет свободную З'-гидроксильную группу. Характерная особенность этой молекулы - высокое содержание оснований, отличных от А, U, G и С. В ней содержится девять необычных нуклеотидов: инозин, псевдоуридин, дигидроуридин, риботимидин и метилированные производные гуанозина и инозина. Участок прикрепления аминокислоты представляет собой З'-гидроксильную группу остатка аденозина на З'-конце молекулы. Последовательность IGС в середине молекулы - антикодон. Он комплементарен GСС - одному из кодонов аланина.
Рис. 27.4. Последовательность оснований дрожжевой аланиновой тРНК. Модифицированные нуклеозиды (отмечены зеленым) сокращенно обозначаются следующим образом: инозин - I, метилинозин - mI, дигидро- уридин - UH2, риботимидин - Т, псевдоуридин - ![]() , метилгуанозин - mG и диметилгуано- зин - m2G
, метилгуанозин - mG и диметилгуано- зин - m2G
Вскоре были определены последовательности нескольких других молекул тРНК. К настоящему времени уже известны последовательности более 70 тРНК. Самое удивительное, что все эти последовательности можно изобразить в форме клеверного листа, в котором около половины нуклеотидов образует пары оснований. Следовательно, молекулы тРНК обладают многими общими структурными особенностями. В этом факте нет ничего неожиданного, так
как все молекулы тРНК должны взаимодействовать примерно одинаковым образом с рибосомами и мРНК. Говоря конкретно, все молекулы тРНК должны укладываться в А- и Р-участки рибосомы и должны взаимодействовать с ферментом, катализирующим образование пептидной связи.
Все молекулы транспортных РНК обладают следующими общими свойствами.
1. Все они представляют собой одну цепь длиной от 73 до 93 рибонуклеотидов (масса около 25 кДа).
2. Они содержат много необычных оснований, как правило, от 7 до 15 на молекулу. Многие из этих необычных оснований представляют собой метилированные или диметилированные производные А, U, С и G, которые образуются путем ферментативной модификации тРНК-предшественника (разд. 25.17). Роль этих необычных оснований неизвестна. Вполне возможно, что метилирование препятствует спариванию некоторых оснований и делает их таким образом доступными для других взаимодействий. Кроме того, метилирование изменяет гидрофобность некоторых участков тРНК, что может иметь важное значение для их взаимодействия с синтетазами и рибосомными белками.
3. 5'-конец тРНК фосфорилирован. На 5'-конце обычно расположен остаток рG.
4. На З'-конце всех тРНК находится последовательность ССА. Активированная аминогруппа прикрепляется к З'-гидроксильной группе концевого аденозина.
5. Примерно половина нуклеотидов тРНК спарена и образует участки двойной спирали (рис. 27.5). Не спарены пять групп оснований: 3'-концевая область ССА (акцепторная ветвь); T![]() С-петля, которая получила свое название по последовательности риботимидин - псевдоурацил - цитозин; добавочная петля, число остатков которой различно в разных тРНК; дигидроуридиловая петля, которая содержит несколько остатков дигидроуридина; антикодоновая петля.
С-петля, которая получила свое название по последовательности риботимидин - псевдоурацил - цитозин; добавочная петля, число остатков которой различно в разных тРНК; дигидроуридиловая петля, которая содержит несколько остатков дигидроуридина; антикодоновая петля.
6. Антикодоновая петля состоит из семи оснований, расположенных в следующей последовательности:
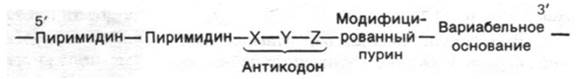
Рис. 27.5. Общая схема строения молекул тРНК
27.4. Транспортная РНК имеет L-образную форму
К настоящему времени трехмерная структура молекулы тРНК установлена на атомном уровне благодаря рентгеновским кристаллографическим исследованиям, осуществленным в лабораториях Александра Рича и Арона Клуга (Alexander Rich, Aaron Klug). В результате проведенного ими независимого рентгенографического изучения фенилаланиновой тРНК получено множество новых данных о структуре молекулы тРНК.
1. Молекула имеет L-образную форму (рис. 27.6 и 27.7).
Рис. 27.6. Фотография скелетной модели дрожжевой фенилаланиновой тРНК, основанная на карте электронной плотности с разрешением 3 А
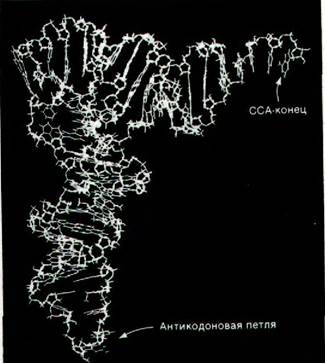
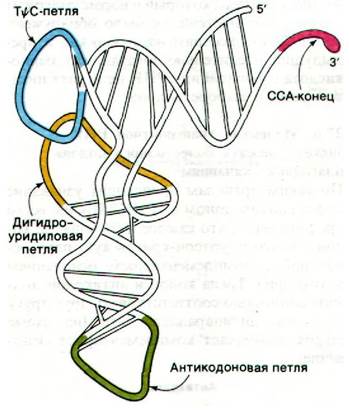
Рис. 27.7. Схематическое изображение трехмерной структуры дрожжевой фенилаланиновой тРНК
2. В молекуле имеется два участка двойной спирали. Каждая из этих спиралей содержит примерно десять пар оснований, что соответствует одному витку спирали. Спиральные участки расположены перпендикулярно друг другу, что и придает молекуле L-образную форму. Схема спаривания оснований, постулированная в модели клеверного листа, построенной по результатам определения последовательности, оказалась правильной.
3. Большинство оснований вне спиральных участков образует необычные водородные связи. Эти третичные взаимодействия возникают между основаниями, которые обычно не комплементарны друг другу (например, G—G, А—А и А—С). Более того, рибозофосфатный остов взаимодействует с некоторыми основаниями и даже с другим участком самого остова. Во многих подобных взаимодействиях 2'-ОН- группа остатков рибозы выступает в качестве донора или акцептора при образовании водородных связей. Кроме того, значительная часть оснований упакована в стопки (межплоскостные взаимодействия). Эти гидрофобные взаимодействия между соседними ароматическими кольцами играют основную роль в молекулярной архитектуре.
4. ССА-конец - участок прикрепления аминокислоты - расположен на одном из концов L. Другой конец L представляет собой антикодоновую петлю. Таким образом, аминокислота, связанная в аминоацил- тРНК, удалена от антикодона (на расстояние примерно 80 А). Дигидроуридиловая петля и Т![]() С-петля образуют угол буквы L.
С-петля образуют угол буквы L.
5. ССА-конец и прилегающая к нему спиральная область не очень сильно взаимодействуют с остальной молекулой. Эта часть молекулы может изменять конформацию при активации аминокислоты и при синтезе белка на рибосоме.
Определение трехмерной структуры тРНК - важный шаг в изучении процесса трансляции на молекулярном уровне. Еще совсем недавно решение этого вопроса казалось делом далекого будущего. Теперь идеи и усилия исследователей в данной области обращаются к еще более сложным задачам, таким, как изучение трехмерной структуры комплексов аминоацил-тРНК— синтетазы с тРНК и даже тРНК, связанной с мРНК и рибосомными белками.