БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 28. РЕГУЛЯЦИЯ ВЫРАЖЕНИЯ ГЕНА В ФЕНОТИПЕ
Мы уже видели, что активность многих белков регулируется с помощью различных механизмов, например, протеолитической активации, аллостерических взаимодействий и ковалентной модификации. В этой главе рассматривается регуляция скорости синтеза белка, которая также играет принципиально важную роль в общей картине метаболизма клетки. У бактерий активность гена регулируется в основном на уровне транскрипции, а не трансляции. Мы сосредоточим внимание на лактозном и триптофа- новом оперонах Е. coli и на регуляторных аспектах цикла развития бактериофага так как молекулярные механизмы регуляции в этих системах хорошо изучены. Более того, именно интенсивное исследование этих систем позволило сформулировать некоторые общие принципы регуляции выражения гена в фенотипе (экспрессии гена) у прокариот и вирусов. Экспрессия гена у эукариот регулируется иначе, как это станет очевидно из следующей главы.
28.1. β-Галактозидаза - индуцибельный фермент
Е. coli может использовать лактозу в качестве единственного источника углерода.
Главный фермент в метаболизме этого сахара - β-галактозидаза, гидролизующая лактозу на галактозу и глюкозу (рис. 28.1). При выращивании на лактозе клетка Е. coli содержит несколько тысяч молекул β-галактозидазы. Если же выращивать Е. coli на других источниках углерода, например, на глюкозе или глицероле, то число молекул β-галактозидазы на клетку не достигает десяти. Лактоза индуцирует значительное увеличение количества β-галактозидазы в клетке Е. coli, причем она вызывает синтез новых молекул фермента, а не активирует профермент (рис. 28.2). Следовательно, β-галакто- зидаза - индуцибельный фермент. Одновременно и согласованно с β-галактозидазой синтезируются еще два белка - галактозид- пермеаза и тиогалактозид-трансацетилаза. Пермеаза необходима для переноса лактозы через бактериальную клеточную мембрану, трансацетилаза же не имеет существенного значения для метаболизма лактозы. Физиологическая роль трансацетилазы пока не установлена, in vitro она катализирует перенос ацетильной группы ацетил-СоА на гидроксильную группу при С-6 тиогалактозида.
Рис. 28.1. β-Галактозидаза гидролизует лактозу
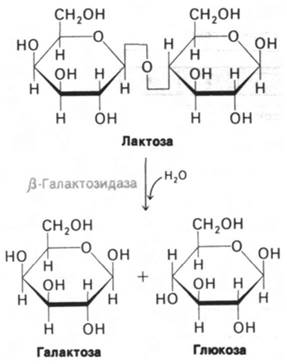
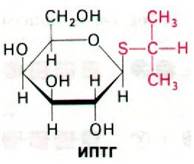
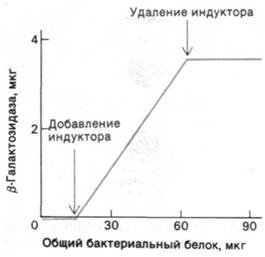
Рис. 28.2. Увеличение количества β-галактозидазы идет параллельно увеличению числа клеток в растущей культуре Е. соli. Наклон этого графика указывает, что β-галактозидазасоставляет 6,6% всего синтезируемого белка
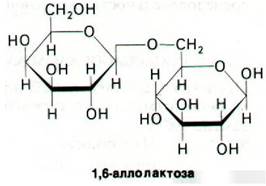
Физиологическим индуктором β-галактозидазы является аллолактоза, которая образуется из лактозы в результате реакции трансгликозилирования. Синтез аллолактозы катализируется теми несколькими молекулами β-галактозидазы, которые имеются в клетке еще до индукции. Изучение природы индукторов показало, что некоторые β-галактозиды служат индукторами, не являясь при этом субстратами β-галактозидазы, тогда как другие соединения ведут себя как субстраты, не будучи при этом индукторами. Например, изопропилтиогалак- тозид (ИПТГ) неметаболизируемый индуктор (его также называют холостым индуктором).