БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 29. ЭУКАРИОТИЧЕСКИЕ ХРОМОСОМЫ И ВЫРАЖЕНИЕ ГЕНОВ У ЭУКАРИОТ
29.30. Сигнальные последовательности позволяют секреторным белкам проходить через мембрану эндоплазматического ретикулума
Исследования белоксинтезирующей активности рибосом в бесклеточных системах дали ответ на первый вопрос. Выделяли свободные рибосомы из цитозоля и добавляли их к препарату мембран шероховатого ЭР, с которых были удалены рибосомы. Эта реконструированная система в присутствии соответствующих мРНК и других растворимых факторов активно синтезировала секреторные белки. Точно так же рибосомы, полученные из препарата шероховатого ЭР, проявляли нормальную активность при синтезе белков, которые остаются в цитозоле. Кроме того, никаких структурных различий между свободными рибосомами и рибосомами, полученными из шероховатого ЭР, не обнаруживалось. Следовательно, связанные с мембранами рибосомы и свободные рибосомы, по сути, одинаковы. Остается ли данная рибосома свободной или прикрепляется к шероховатому ЭР, определяется только природой белка, который она синтезирует.
Какая же особенность синтезирующегося белка определяет, плавает ли ассоциированная с ним рибосома свободно в цитозоле или связывается с мембраной ЭР? В 1970 г. Дэвид Сабатини и Гюнтер Блобел (David Sabatini, Gunter Blobel) постулировали, что сигналом прикрепления служит последовательность аминокислотных остатков, прилегающая к N-концу новообразующейся полипептидной цепи. Вскоре эта гипотеза сигнальной последовательности (рис. 29.42) нашла подтверждение в работах Сезара Мил- стайна и Джорджа Браунли (Cesar Milstein, George Brownlee), показавших, что иммуноглобулиновая цепь, синтезированная in vitro свободными рибосомами, содержит N-концевую последовательность из 20 остатков, которой нет в зрелом белке, синтезированном in vivo. Затем Блобел обнаружил, что все основные секреторные белки поджелудочной железы, синтезированные in vitro на свободных рибосомах, содержат на N-конце дополнительные фрагменты длиной около двадцати аминокислот. В настоящее время сигнальные последовательности многих секреторных белков расшифрованы. Они имеют длину от 15 до 30 остатков и содержат много неполярных аминокислот (рис. 29.43).
Рис. 29.42. Гипотеза сигнальной последовательности, образующейся при биосинтезе секреторных и мембранных белков. Согласно этой гипотезе, N-концевая последовательность новообразованной полипептидной цепи (показана красным) привязывает рибосому к мембране ЭР. Затем сигнальная последовательность удаляется пептидазой, расположенной на внутренней стороне ЭР
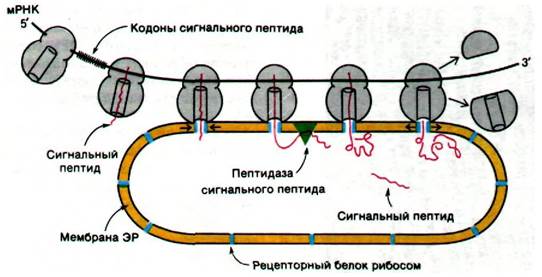
Рис. 29.43. Сигнальные последовательности двух секреторных белков. Гидрофобные остатки отмечены желтым. Место расщепления указано красной чертой

Гидрофобные сигнальные последовательности, видимо, принимают конформации, которые узнаются белками мембраны ЭР, образующими каналы. По всей вероятности, новообразующиеся полипептидные цепи активно протягиваются через канал в ЭР по мере синтеза. Затем особая пептидаза отщепляет сигнальные последовательности на внутренней стороне ЭР (см. рис. 29.42). Новообразующиеся цепи, которые должны стать составной частью мембраны, по-видимому, содержат специальные последовательности, блокирующие перенос полипептида через мембрану ЭР до тех пор, пока синтез не доходит до С-конца. В случае же секреторных белков, наоборот, через мембрану ЭР транспортируется вся полипептидная цепь.
Главная особенность механизма сигнальных последовательностей состоит в том, что перенос полипептида через мембрану ЭР сопряжен с трансляцией. Однако некоторые белки могут пересекать мембрану уже после того, как их синтез завершен. Например, белки митохондрий и хлоропластов в большинстве своем кодируются ядерными генами и синтезируются па свободных рибосомах. Эти белки выходят в цитозоль и затем проходят через мембрану органеллы. Очевидно, транспорт этих белков происходит посттрансляционно, а не во время трансляции. Интересно отметить, что эти митохондриальные и хлоропластные белки, подобно секреторным белкам, содержат N-концевые последовательности, которые удаляются вскоре после их проникновения через мембрану.
Сокращения, принятые для обозначения сахаров:
Fuc - фукоза Gal - галактоза Glc - глюкоза
GlcNAc - N-ацетилглюкозамин Маn - манноза
NAN - N-ацетилнейраминидат (сиаловая кислота)
29.31. Присоединение сахарных остатков «ядра» к гликопротеинам происходит в эндоплазматическом ретикулуме при участии донора долихола
Почти ко всем белкам, синтезированным рибосомами, связанными с ЭР, присоединяются ковалентно связанные углеводные остатки. Растворимые белки, синтезируемые свободными рибосомами в цитозоле, наоборот, почти никогда не связаны с углеводами. Как уже упоминалось (разд. 10.12), остатки сахара, очевидно, ориентируют гликопротеины в мембранах. Кроме того, углеводные группы могут в какой-то степени предопределять судьбу гликопротеина. Обычно гликопротеин содержит одну или несколько олигосахаридных групп, присоединенных к аспарагиновым боковым цепям N-гликозидными связями. Реже сахара прикрепляются к сериновым или треониновым боковым цепям О-гликозидными связями. Непосредственно с остатками аспарагина всегда связан N-ацетилглюкозамин, тогда как к серину и треонину присоединяется N-ацетилгалактозамин.
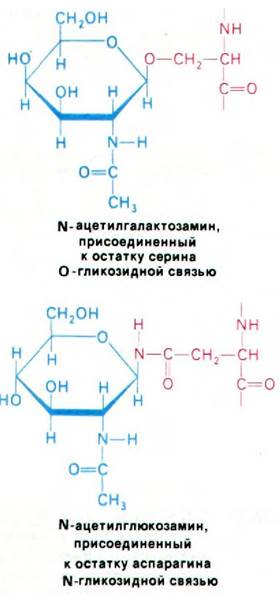
В гликопротеинах встречаются самые разнообразные олигосахариды (рис. 29.44). Однако в основе этого разнообразия лежит общий план строения: углеводные остатки, присоединенные к остаткам аспарагина (через атом азота), имеют общее внутреннее олигосахаридное «ядро». Этот повторяющийся мотив отражает способ биосинтеза олигосахаридной части гликопротеинов: общий олигосахаридный блок (рис. 29.45) переносится с активирующего липидного переносчика на растущую полипептидную цепь на внутренней стороне мембраны ЭР. Переносчиком служит долихолфосфат - липид с очень длинной цепью, содержащий около двадцати изопреновых (С5) остатков. Концевая фосфатная группа этого весьма гидрофобного переносчика - место прикрепления активированного олигосахарида.
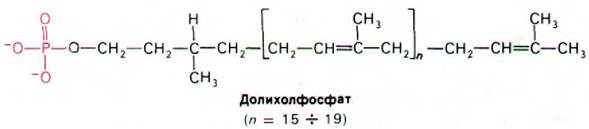
Рис. 29.44. Структура олигосахаридного остатка, связанного с аспарагином в человеческом иммуноглобулине (А) и в тиреоглобулине свиньи (Б)

Рис. 29.45. Структура активированного олигосахаридного «ядра» (показано синим цветом). Переносчик (показан желтым цветом) - долихолфосфат (Дх)
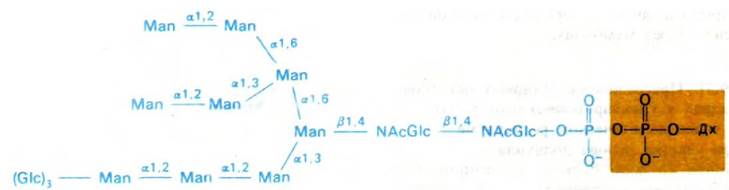
К долихолфосфату присоединяется олигосахаридный блок, состоящий из двух остатков ^ацетилглюкозамина, девяти манноз и трех глюкоз. Его образование идет путем последовательного присоединения моносахаридов (рис. 29.46).
Рис. 29.46. Активированное олигосахаридное ядро синтезируется путем последовательного присоединения отдельных остатков сахаров. Затем весь блок переносится на боковую цепь определенного остатка аспарагина новообразованного белка во внутреннем пространстве ЭР
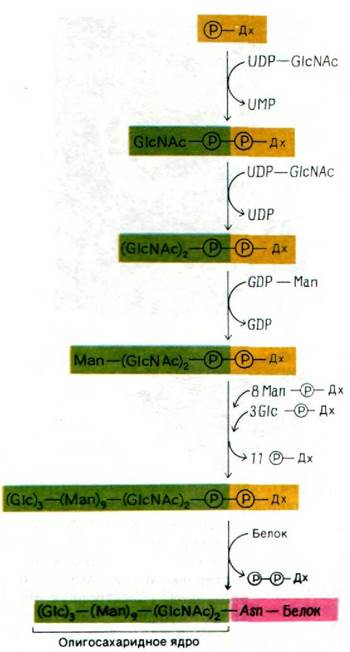
Активированные доноры сахаров в этих реакциях - производные UDP, GDP и долихо- ла. Ряд специфических трансфераз катализирует синтез активированного олигосахаридного «ядра». Затем оно переносится целиком на определенный остаток аспарагина растущей полипептидной цепи. Активированный олигосахарид и специфическая трансфераза расположены на внутренней стороне ЭР. Об этом свидетельствует тот факт, что белки в цитозоле не гликозилированы. Олигосахарид может быть присоединен только к такому аспарагину, который входит в последовательность Asn-X-Ser или Asn-X-Thr. В большинстве случаев два из трех остатков глюкозы присоединенного олигосахарида быстро удаляются, когда гликопротеин еще связан с ЭР.
При переносе олигосахарида на белок высвобождается долихолпирофосфат, который под действием фосфатазы снова превращается в долихолфосфат. Это превращение блокируется антибиотиком бацитрацином (разд. 32.6). Еще один интересный антибиотик-ингибитор - туникамицин, гидрофобный аналог UDP-N-ацетилглюкозамина. Туникамицин блокирует первый этап образования олигосахаридного «ядра» - присоединение N-ацетилглюкоза- мина к долихолфосфату.
29.32. Модификация и сортировка гликопротеинов происходит в аппарате Гольджи
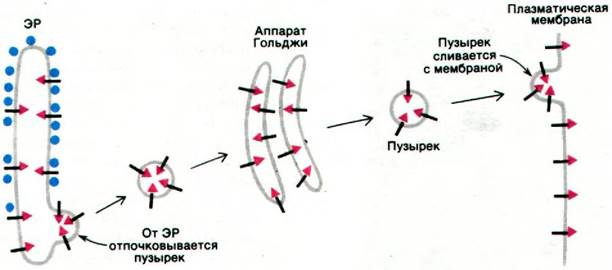
Белки, находящиеся во внутреннем пространстве ЭР и в его мембране, переносятся в аппарат Гольджи - стопку уплощенных мембранных мешков (рис. 29.47). В этой органелле олигосахаридное «ядро» гликопротеинов удаляется и к ним присоединяются новые сахара. Кроме того, аппарат Гольджи сортирует и упаковывает гликопротеины для транспортировки в другие участки клетки. Гликопротеины доставляются из ЭР к выпуклой поверхности аппарата Гольджи в пузырьках диаметром 500 А, окруженных оболочкой, покрытой чем-то вроде щетинок (рис. 29.48). Эта оболочка представляет собой многогранную решетчатую структуру, состоящую из субъединиц клатрина массой 180 кДа (рис. 29.49). Эти так называемые окаймленные пузырьки отпочковываются от ЭР и затем сливаются с аппаратом Гольджи. Кроме того, они переносят мембранные белки от вогнутой поверхности аппарата Гольджи в лизосомы, к плазматической мембране и в другие участки клетки. К тому же окаймленные пузырьки переносят белки и липиды от плазматической мембраны к внутренним мембранам. Таким образом, клатрин играет ключевую роль в переносе фрагментов мембраны в пределах клетки. Важно отметить, что во время этих процессов переноса асимметрия мембран сохраняется. Внутренняя поверхность мембраны
окаймленного пузырька и аппарата Гольджи соответствует внутренней стороне мембраны ЭР. Когда окаймленные пузырьки сливаются с плазматической мембраной, их внутренняя поверхность становится наружной поверхностью плазматической мембраны. Следовательно, внутренние поверхности мембраны ЭР и других органелл соответствуют наружной поверхности плазматической мембраны (рис. 29.50). По этой причине углеводные группы гликопротеинов плазматической мембраны всегда расположены на ее наружной поверхности (разд. 10.12).
Рис. 29.47. Электронная микрофотография (вверху) и схематическое изображение (внизу) аппарата Гольджи. В этой органелле происходит модификация, сортировка и упаковка гликопротеинов
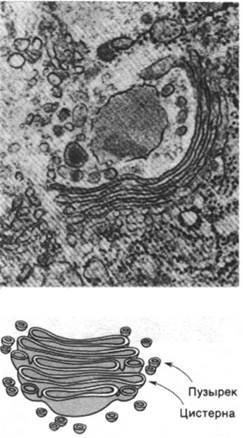
Рис. 29.48. Электронная микрофотография окаймленных пузырьков (вверху). Схема окаймленного пузырька
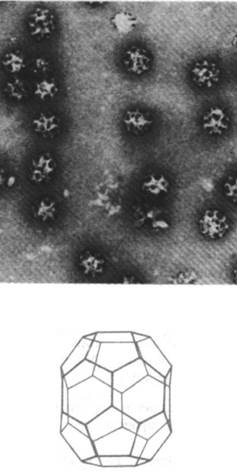
Рис. 29.49. Изображение реконструированного окаймленного пузырька. Оно получено наложением многих электронных микрофотографий

Рис. 29.50. Асимметрия клеточных мембран. Внутренние поверхности ЭР и других органелл соответствуют наружной поверхности плазматической мембраны
В аппарате Гольджи происходит перестройка олигосахаридных групп гликопротеинов. Единственная оставшаяся глюкоза и несколько оставшихся манноз олигосахаридного «ядра» удаляются. На этом формирование углеводных остатков некоторых гликопротеинов заканчивается. Более сложные олигосахариды других гликопротеинов образуются путем последовательного присоединения сахаров к остаткам «ядра». Например, в качестве активированных доноров при синтезе концевого трисахаридного остатка, обнаруженного в некоторых гликопротеинах, выступают UDP- N-ацетилглюкозамин, UDP-галактоза и СМР-нейраминидат (рис. 29.51). Этот последний этап биосинтеза, протекающий в аппарате Гольджи, получил название окончательного гликозилирования - в отличие от гликозилирования олигосахаридного «ядра», которое происходит в ЭР.
Рис. 29.51. Завершающая стадия синтеза, содержащего нейраминидат углеводного остатка гликопротеина (трансферрина человека). Эта реакция происходит в аппарате Гольджи
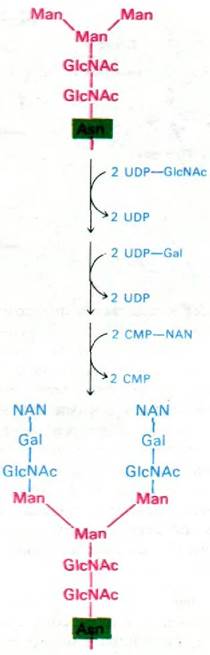
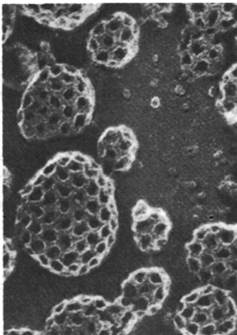
Рис. 29.52. Электронная микрофотография окаймленных пузырьков, лежащих на плазматической мембране клетки
Как происходит сортировка гликопротеинов в аппарате Гольджи? Каким путем они доставляются в места назначения? Ответа на эти интригующие вопросы пока нет, но ключом к пониманию проблемы может послужить болезнь I-клеток (ее также называют муколипидозом II). Это нарушение функции лизосом наследуется как аутосомный рецессивный признак и характеризуется сильной задержкой психомоторного развития и деформацией скелета. Лизосомы в соединительных тканях больных содержат крупные включения (название болезни происходит от англ. inclusion - включение) непереваренных гликозаминогликанов и гликолипидов. Наличие этих включений обусловлено отсутствием в лизосомах больных по меньшей мере восьми ферментов, необходимых для их расщепления. В то же время огромные количества этих ферментов обнаруживаются в моче и крови больных. Следовательно, синтез активных ферментов при болезни I-клеток происходит, но вместо того, чтобы запасаться в лизосомах, они экспортируются из клетки. Другими словами, при болезни I-клеток целый ряд ферментов локализуется в неправильном месте. Эти ферменты не содержат маннозо-6-фосфата, который обычно с ними связан. Следовательно, маннозо-6-фосфат, по всей вероятности, представляет собой маркер, направляющий в норме многие гидролитические ферменты из аппарата Гольджи в лизосомы. Интересно выяснить, участвуют ли углеводные остатки других гликопротеинов в регуляции внутриклеточных передвижений.