БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 32. ОБОЛОЧКИ БАКТЕРИАЛЬНЫХ КЛЕТОК
32.12. Грамотрицательные бактерии окружены наружной мембраной, богатой липополисахаридами
Как уже упоминалось, клеточная оболочка грамотрицательных бактерий устроена более сложно, чем клеточная оболочка грамположительных бактерий. У грам-отрица- тельных микроорганизмов (например, Escherichia coli или Salmonella typhimurium) слой пептидогликана окружен наружной мембраной, содержащей фосфолипиды, белки и липополисахариды. Эта наружная мембрана, подобно плазматической, имеет структуру бислоя. Итак, грам-отрица- тельные бактерии имеют две мембраны, а грамположительные - одну. Особенность грамотрицательных бактерий состоит также в наличии водной прослойки между плазматической мембраной и пептидогли- кановым слоем. В этом периплазматическом пространстве содержится много белков, участвующих в связывании и транспорте сахаров и других питательных веществ (разд. 37.20).
Липополисахариды (ЛПС) наружной мембраны представляют собой крайне необычные соединения, молекулы которых состоят из трех частей: липида А, олигосахаридов сердцевины («ядра») и О-боковой цепи (рис. 32.18). Липид А - это гидрофобная часть большой (10 кДа) амфипатической молекулы. Он включает шесть цепей насыщенных жирных кислот, присоединенных к двум остаткам глюкозамина. Эти ацильные цепи составляют примерно половину наружного слоя наружной мембраны. Внутренний слой вместо цепей жирных кислот содержит фосфолипиды (рис. 32.19). Далее в молекуле липополисахарида идет область олигосахаридного «ядра». Здесь десять углеводных единиц вынесено кнаружи от липида А; еще более наружно располагается О-боковая цепь, состоящая из большого числа повторяющихся тетрасахаридных единиц. В этих двух областях содержится несколько крайне редких в природе углеводов, а именно 8-углеродный сахар 2-кето-3-дезоксиоктонат (КДО, КDО), 7-углеродный сахар гептоза, а также 6-углеродные сахара L-рамноза и абеквоза, в молекуле которых в положении С-6 стоит —СН3 вместо —СН2ОН (рис. 32.20). В отличие от ацильной части липида А олигосахариды сердцевины и О-боковая цепь высоко гидрофильны. Ряд сахаров в липополисахариде фосфорилирован, и потому молекула полисахарида в целом имеет отрицательный заряд.
Рис. 32.18. Молекула липополисахарида состоит из трех частей: липида А, олигосахаридного «ядра» и О-боковой цепи. Здесь показана последовательность сахаров, характерная для Salmonella typhimurium. Сокращения: Abe - абеквоза; EtN - этаноламин; Gal-галактоза; Glc- глюкоза; GlcN - глюкозамин; GlcNAc - N-ацетил- глюкозамин; Hep - гептуле- за; KDO - 2-кето-3-дезоксиоктонат; Man - манноза; Rha - L-рамноза
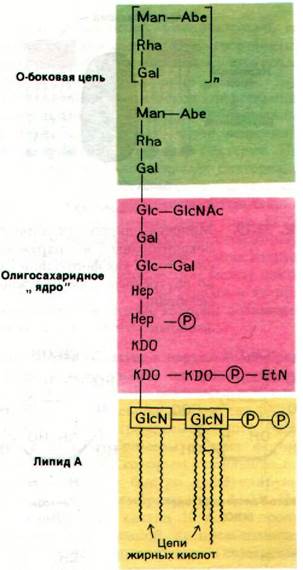
Рис. 32.19. Молекулы липополисахаридов локализованы в наружном слое, тогда как фосфолипиды - во внутреннем слое наружной мембраны
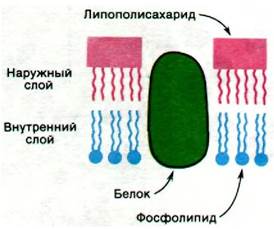
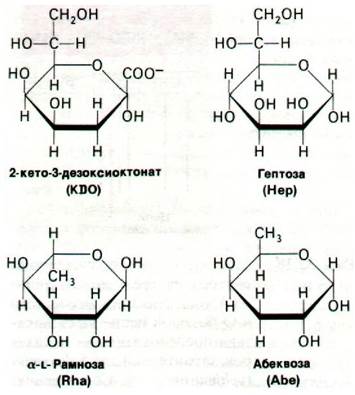
Рис. 32.20. Формулы ряда редких сахаров, входящих в состав липополисахаридов
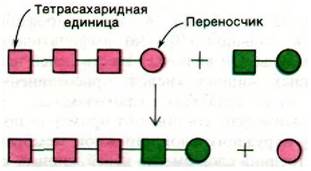
Липополисахариды синтезируются в плазматической мембране и затем транспортируются в наружную мембрану. Сначала синтезируется липид А, а затем путем последовательного присоединения сахаров (донорами активированных сахаров служат соединения типа UDР-глюкозы или UDР-галактозы) образуется полисахаридное «ядро». О-боковая цепь собирается иным путем. Ее повторяющееся тетрасахаридное звено синтезируется на том же самом С55-изопреноидном липидном переносчике, который участвует в синтезе пептидогликана (разд. 32.4). Растущая цепь таких единиц удлиняется путем переноса олигосахарида с одной молекулы переносчика на тетраса- харидное звено, связанное с другой молекулой переносчика (рис. 32.21). Аналогичный способ удлинения имеет место при синтезе жирных кислот (разд. 17.18) и белков (разд. 27.16). Наконец, О-боковая цепь присоединяется к концу олигосахаридного «ядра». По-видимому, повторяющийся тетрасахарид О-боковой цепи образуется во внутреннем слое плазматической мембраны, затем переносится в наружный слой и там присоединяется к растущей цепи. Полностью сформированная молекула липополисахарида транспортируется из плазматической мембраны в наружную, по-видимому, в тех участках, в которых эти структуры соприкасаются.
Рис. 32.21. Способ удлинения О-боковых цепей
32.13. Благодаря разнообразию О-боковых цепей грам-отрицательные бактерии противостоят защитным силам организма-хозяина
Липополисахариды содержат в высшей степени необычные сахара и своеобразные химические связи. Что дает такая вычурность? Ключ к решению этого вопроса был получен при изучении мутантов, дефектных по синтезу липополисахаридов. Липид А и прилегающие к нему КДО олигосахаридного «ядра», по-видимому, абсолютно необходимы для выживания. Цепи насыщенных жирных кислот вносят определенный вклад в барьерную функцию наружной мембраны, благодаря которой периплазматические белки не выходят наружу, а наиболее ядовитые вещества не проникают в клетку. Так, пенициллин довольно плохо проходит сквозь клеточную мембрану грамотрицательных бактерий. Кроме того, липид А придает наружной мембране жесткость. В отличие от липида А и олигосахаридного «ядра» О-боковые цепи не являются жизненно важными. Например, любимый многими биохимиками штамм К12 Е. coli вообще лишен О-боковых цепей. Все же в естественных условиях грамотрицательные бактерии почти всегда имеют О-боковые цепи. Полисахаридная наружная оболочка придает поверхности бактериальных клеток высокую степень гидрофильности, что повышает их устойчивость к фагоцитозу клетками хозяина. О-боковые цепи полисахаридов крайне разнообразны; показанная на рис. 32.18 структура - это только одна из многих известных. Грамотрицательные бактерии способны быстро мутировать, изменяя таким путем состав своих О-боковых цепей. В результате популяция клеток хозяина, встретившись с новой для себя поверхностной структурой, не имеет на первых порах достаточного количества антител про
тив О-боковых цепей. Следовательно, видоизменяя О-боковые цепи, микроорганизмы на один шаг опережают систему иммунологической защиты организма-хозяина.
Рис. 32.22. Изменение структуры О-боковых цепей бактерии Salmonella при заражении умеренным фагом Р22

Источником генетической информации, необходимой для изменения О-боковых цепей, может служить включение умеренного фага в грам-отрицательные бактерии. Например, фаг Р22 обеспечивает бактериальную клетку геном фермента, добавляющего глюкозу к повторяющемуся тетрасахарид- ному звену в О-боковых цепях (рис. 32.22). Такое изменение называют фаговой конверсией. Приведенный пример демонстрирует удивительное взаимодействие между бактериальными и вирусными генами и те преимущества в эволюции, которые возникают в результате такого симбиоза.
32.14. Порин образует в наружной мембране каналы для небольших полярных молекул
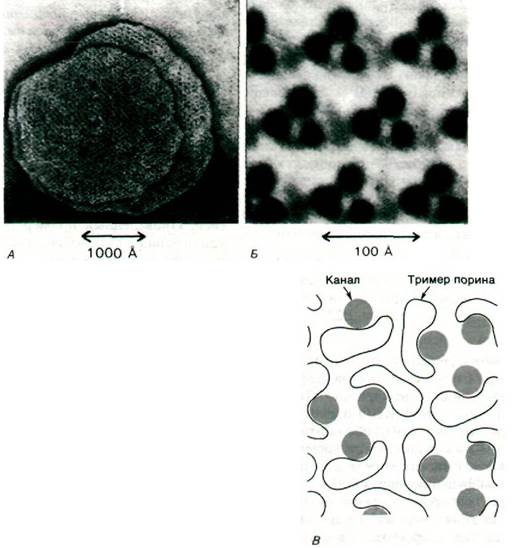
В наружной мембране бактериальной клетки содержится большое количество (~105) молекул порина - трансмембранного белка массой 37 кДа. Тримеры порина формируют каналы, по которым небольшие полярные молекулы быстро диффундируют, проходя сквозь мембрану (рис. 32.23). Поскольку диаметр канала 10 А, он пропускает молекулы массой, не превышающей 600 Да. Гидрофобные молекулы независимо от своего размера плохо проходят по каналу; из этого следует, что пориновый канал наполнен водой и выстлан полярными группами. Следовательно, канал приспособлен для пропускания небольших полярных метаболитов типа моносахара. Что касается полярных соединений с большей молекулярной массой, то для некоторых из них существуют специфические системы транспорта через наружную мембрану; примером может служить система транспорта мальтозы. Диффузия мальтозы (дисахарида) и мальтотриозы по пориновому каналу идет очень медленно; для их переноса через мембрану существует специальная система транспорта. Известны также специфические системы транспорта витамина В12 и хелатов железа. Некоторые фаги проникают в бактериальные клетки путем связывания со специфическими переносчиками. Так, фаг X использует рецептор мальтозы.
Рис. 32.23. А. Электронная микрофотография Е. coli. Видно расположение негативно окрашенных пориновых каналов. Б. Изображение пориновых каналов, полученное после обработки и фильтрации (обесцвечивания фона) микрофотографии, приведенной на рис. А. В. Разъясняющая схема: показана проекция каналов порина
при низком разрешении
Среди белков наружной мембраны количественно преобладает (~ 7 • 105 молекул на клетку) небольшой липопротеин, содержащий всего лишь 58 остатков аминокислот. Этот белок характеризуется высокой степенью а-спирализованности; к его N-концевому цистеину ковалентно присоединены три жирные кислоты. Примерно 1/3 молекул липопротеина через ε-аминогруппы своего С-концевого лизина связана с СООН-группами расположенного над ним пептидогликана. Таким образом, рассматриваемый липопротеин прикрепляет наружную мембрану к подлежащему пептидо- гликанномуслою и тем самым способствует механической устойчивости клеточной оболочки.
32.15. Новообразованные белки наружной мембраны содержат отщепляемую сигнальную последовательность
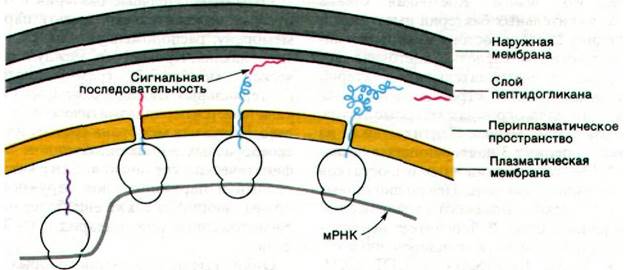
Белки, синтезируемые грам-отрицательны- ми бактериями, могут локализоваться в цигозоле, плазматической мембране, периплазматическом пространстве, наружной мембране или внеклеточной среде. Каким образом новосинтезированная молекула попадает в нужное место, выбирая из пяти возможных направлений правильное? Для выяснения этого вопроса очень важное значение имеет следующий факт: как оказалось, липопротеин наружной мембраны синтезируется в виде пролипопротеина, содержащего на N-конце 20 дополнительных остатков аминокислот (рис. 32.24). Аналогичным образом и другие белки, предназначенные для плазматической мембраны или еще более наружно расположенных участков, несут сигнальные последовательности, отличающие их от тех белков, которые остаются в цитозоле. Рибосомы, синтезирующие белки, предназначенные для выхода из цитозоля, соединяются с плазматической мембраной посредством именно этих крайне гидрофобных N-концевых последовательностей. Таким образом, начальные этапы процесса секреции у прокариот и эукариот очень сходны (разд. 29.30). Однако есть и различие: у прокариот рибосомы, синтезирующие белки клеточной оболочки, прикрепляются к плазматической мембране (рис. 32.25), тогда как у эукариот рибосомы с аналогичной функцией связываются с эндоплазматическим ретикулумом (разд. 29.29). Как и у эукариот, пептидазы прокариот отщепляют сигнальные последовательности новосинтезированных белков, как только эти белки минуют барьер мембраны.
Рис. 32.24. Последовательность аминокислот N-концевой части пролипопротеина. Эта сигнальная последовательность содержит много гидрофобных остатков (показаны желтым цветом)

Рис. 32.25. У прокариот синтез белков клеточной оболочки происходит на рибосомах, прикрепленных к плазматической мембране. Сигнальная последовательность (показана красным цветом) новообразованного полипептида направляет рибосомы к плазматической мембране, а также обеспечивает перенос белка через нее
Гипотеза сигнальных последовательностей подтверждается данными, полученными при изучении бактериальных мутантов; проиллюстрируем это на примере белка, связывающего мальтозу: его масса 38 кДа, он участвует в поглощении мальтозы клеткой. Обычно этот белок локализован в пери- плазматическом пространстве. Однако при мутации, затрагивающей N-конец его предшественника, локализация белка (в его зрелой форме) меняется: замещение гидрофобной аминокислоты в сигнальной последовательности на заряженный остаток приводит к накоплению связывающего мальтозу белка в цитозоле. Таким образом, следствием замены всего лишь одного аминокислотного остатка оказалось изменение локализации белка: вместо периплазматического пространства - цитозоль. Рассмотрим обратную ситуацию: может ли белок цитозоля ошибочно попасть в наружную мембрану? Часть гена, ответственного за синтез N-концевой части белка-переносчика мальтозы (белок наружной мембраны, являющийся также рецептором фага ![]() ), соединили с геном β-галактозидазы. Кодируемый полученным геном белок-химера накапливался не в цитозоле, как это свойственно β-галактозидазе, а в наружной мембране. Этот опыт показывает, что N-концевая последовательность новосинтезированной полипептидной цепи - это своего рода форма записи адреса белков клеточной оболочки. Совершенно очевидно, что клетки прокариот, как и эукариот, способны транспортировать белки в соответствующие участки. Молекулярные основы этого процесса сортировки белков - важная область современных исследований.
), соединили с геном β-галактозидазы. Кодируемый полученным геном белок-химера накапливался не в цитозоле, как это свойственно β-галактозидазе, а в наружной мембране. Этот опыт показывает, что N-концевая последовательность новосинтезированной полипептидной цепи - это своего рода форма записи адреса белков клеточной оболочки. Совершенно очевидно, что клетки прокариот, как и эукариот, способны транспортировать белки в соответствующие участки. Молекулярные основы этого процесса сортировки белков - важная область современных исследований.