БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 33. ИММУНОГЛОБУЛИНЫ
33.15. Рентгеноструктурный анализ связывающих участков антител показал, как происходит связывание некоторых гаптенов
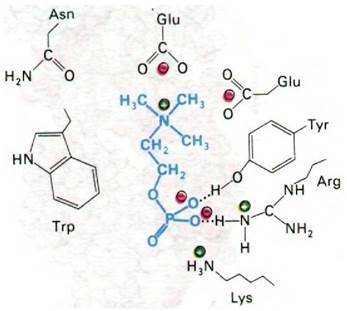
Рентгеноструктурный анализ комплексов гаптенов с фрагментами Fab позволил определить природу антигенсвязывающих участков антител и структурную основу их специфичности. Подтвердилось предсказание, сделанное на основании сопоставления последовательностей аминокислот, а также опытов с аффинной меткой, что антигенсвязывающий участок антитела сформирован остатками гипервариабельных областей как L-цenu, так и Н-цепи. Это хорошо видно на примере связывания производного витамина К1 (рис. 33.20). Аналогично происходит связывание фосфорилхолина в полости, выстланной остатками, принадлежащими пяти гипервариабельным сегментам: двум L-цепи и трем Н-цепи (рис. 33.21). Этот гаптен наиболее прочно связывается с остатками Н-цепи. Его положительно заряженная триметиламмониевая группа уходит в глубь клинообразной полости, где электростатически взаимодействует с двумя отрицательно заряженными боковыми цепями глутамата. Отрицательно заряженная фосфатная группа фосфорилхолина связывается с положительно заряженной гуанидиниевой группой аргининового остатка в устье щели. Кроме того, фосфатная группа образует водородные связи с гидроксилом тирозинового остатка и с аминогруппой боковой цепи аргинина. Многочисленные ван- дерваальсовы взаимодействия, в том числе с боковой цепью триптофана (рис. 33.21), также вносят свой вклад в стабильность этого комплекса.
Рис. 33.20. Способ связывания производного витамина К1 (показано желтым цветом) в участке связывания антигена. Остатки аминокислот гипервариабельного участка Н-цепи изображены розовым цветом, а остатки, принадлежащие L-цепи, синим
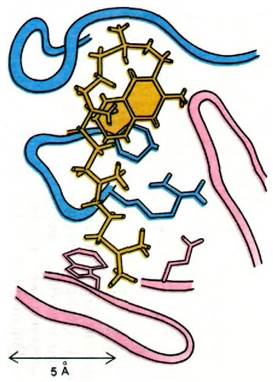
Рис. 33.21. Способ связывания фосфорилхолина (показан синим цветом) с антителом в участке, связывающем антиген
33.16. Разные классы иммуноглобулинов различаются по биологической активности
До сих пор мы рассматривали иммуноглобулин G. Однако существует 5 классов иммуноглобулинов (табл. 33.1), и все они состоят из тяжелых и легких цепей. Константные области тяжелых цепей у иммуноглобулинов разных классов неодинаковы, тогда как легкие цепи одни и те же: либо ![]() , либо ӽ. Тяжелые цепи иммуноглобулина G называются γ-цепями, а тяжелые цепи иммуноглобулинов А, М, D и Е - соответственно α-, μ-, δ- и ε-цепями. Различие тяжелых цепей обусловливает и различие биологических свойств у пяти классов иммуноглобулинов. Как уже упоминалось выше, иммуноглобулин М (IgM) - это класс антител, которые первыми появляются в сыворотке после введения антигена, тогда как иммуноглобулин G (IgG) - основной класс антител сыворотки. На протяжении многих лет IgG называли γ-глобулином, исходя из его электрофоретических характеристик и растворимости. Иммуноглобулин А (IgA) - это основной классе антител, секретируемых с различного рода продуктами внешней секреции (слезная жидкость, слизь бронхиального и кишечного эпителия). Таким образом, IgA служит первой линией зашиты против бактериальных и вирусных антигенов. Какова функция иммуноглобулинов D (IgD) и Е (IgE), пока не известно. Установлено, однако, что иммуноглобулин Е опосредует аллергические реакции и тем самым оказывает вредное действие.
, либо ӽ. Тяжелые цепи иммуноглобулина G называются γ-цепями, а тяжелые цепи иммуноглобулинов А, М, D и Е - соответственно α-, μ-, δ- и ε-цепями. Различие тяжелых цепей обусловливает и различие биологических свойств у пяти классов иммуноглобулинов. Как уже упоминалось выше, иммуноглобулин М (IgM) - это класс антител, которые первыми появляются в сыворотке после введения антигена, тогда как иммуноглобулин G (IgG) - основной класс антител сыворотки. На протяжении многих лет IgG называли γ-глобулином, исходя из его электрофоретических характеристик и растворимости. Иммуноглобулин А (IgA) - это основной классе антител, секретируемых с различного рода продуктами внешней секреции (слезная жидкость, слизь бронхиального и кишечного эпителия). Таким образом, IgA служит первой линией зашиты против бактериальных и вирусных антигенов. Какова функция иммуноглобулинов D (IgD) и Е (IgE), пока не известно. Установлено, однако, что иммуноглобулин Е опосредует аллергические реакции и тем самым оказывает вредное действие.
Таблица 33.1. Свойства иммуноглобулинов разных классов.

33.17. Молекулы антител возникли в результате дупликации и последующей дивергенции генов
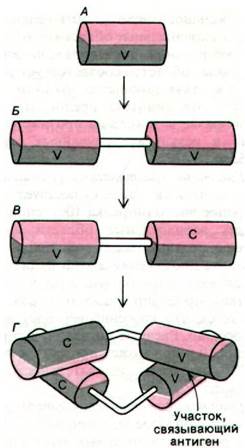
Структурная гомология доменов иммуноглобулинов указывает на характер их происхождения в эволюции. Выше уже рассматривался вопрос о том, что сходство последовательностей аминокислот в молекулах химотрипсина, трипсина, эластазы и тромбина свидетельствует о происхождении этих ферментов от общего предшественника (разд. 8.11). Аналогичным образом внутренняя гомология в молекуле иммуноглобулина свидетельствует о появлении антител в процессе дупликации генов и их последующей дивергенции (видоизменения). Ген-предшественник кодировал, вероятно, примитивную молекулу антитела, состоящую примерно из 108 аминокислотных остатков. Далее, по всей вероятности, происходила дупликация гена-предшественника; в результате дивергенции образовавшихся новых генов возникли разные типы вариабельных и константных областей. Аллен Эдмундсон (Allen Edmundson) высказал предположение, что димер L-цепи выполнял функцию примитивного антитела (рис. 33.22).
Рис. 33.22. Вероятные этапы эволюции примитивных антител. Ген, кодирующий одну полипептидную цепь (А) из 108 аминокислотных остатков, удваивается и дает два идентичных домена (Б), соединенных короткой линейной полипептидной цепью. В результате дивергентной эволюции образовавшихся при удвоении генов аминокислотный состав двух доменов становится различным и возникают (В) вариабельная (V) и константная (С) области, перевернутые одна по отношению к другой. При соединении этих молекул формируется (Г) примитивный F^-фрагмент, обладающий участком связывания антигена