БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 34. МЫШЕЧНОЕ СОКРАЩЕНИЕ И ПОДВИЖНОСТЬ КЛЕТОК
Заключение
Поперечнополосатая мышца позвоночных состоит из белковых нитей двух типов, которые взаимодействуют друг с другом. Толстые нити содержат миозин, а тонкие - актин, тропомиозин и тропонин. Гидролиз АТР актомиозином вызывает скольжение указанных нитей относительно друг друга. Миозин представляет собой очень большой по массе белок (500 кДа), состоящий из двух основных цепей и четырех легких цепей. Конформация основных цепей такова, что они содержат две глобулярные области (головки S1) и присоединенный к ним длинный α-спирализованный стержень. Головки S1 и часть стержня образуют поперечные мостики, которые взаимодействуют с актином, генерируя силу сокращения. Остальная часть молекулы миозина создает скелет толстой нити. Актин - основной компонент тонких нитей - представляет собой глобулярный белок (42 кДа), который полимеризуется с образованием нитей диаметром 70 А. Толстые и тонкие нити определенным образом направлены, причем посе
редине между двумя Z-пластинками это направление меняется на противоположное. Циклическое образование и диссоциация комплексов между миозиновыми поперечными мостиками, выступающими из толстых нитей, и единицами актина тонких нитей происходят за счет энергии АТР; образование комплексов ведет к уменьшению расстояния между Z-пластинками. «Рабочим ходом» является поворот S1-головки миозина, находящейся в комплексе с актином. В генерировании силы сокращения важную роль играют шарнирные соединения между доменами миозина. Мышечное сокращение регулируется Са2+, причем эффект Са2+ опосредован тропонином и тропомиозином. При низкой концентрации Са2+ эти белки ингибируют взаимодействие актина и миозина. Нервный импульс запускает высвобождение Са2+ из саркоплазматического ретикулума. Далее ионы кальция связываются с тропонином, что инициирует серию конформационных сдвигов, разрешающих в итоге взаимодействие актина и миозина.
Рис. 34.33. Динеиновые ручки расположены вдоль микротрубочек с правильной периодичностью. Электронные микрофотографии интактной аксонемы (А) и микротрубочки, реконструированной из тубулина и динеина (Б)
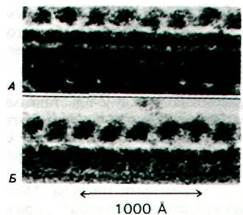
Рис. 34.34. Внутренняя поверхность плазматической мембраны фибробласта под электронным микроскопом. Ясно видны нити актина (декорированные S1-головками миозина) и окаймленные ямки на мембране
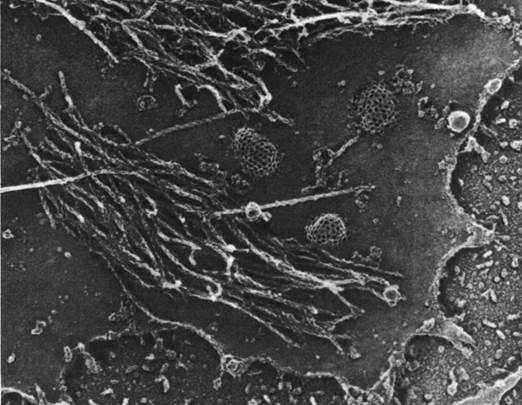
Актин и миозин - эволюционно древние белки, о чем свидетельствует тот факт, что они содержатся уже в слизистых грибах. В сущности, эти белки участвуют в сократительной активности практически всех эукариотических клеток. Особенно распространен актин, образующий микрофиламенты диаметром около 70 А. Микрофиламенты участвуют в разных видах клеточной подвижности, например, в миграции клеток в ходе развития, ретракции кровяного сгустка тромбоцитами, передвижении макрофагов к поврежденным тканям. Сокращение ворсинок щеточной каемки кишечного эпителия опосредовано взаимодействием нитей актина с биполярными нитями миозина; последние в эпителиальных клетках кишечника меньше по размеру и содержатся в меньшем относительном количестве по сравнению с мышцами. Цитохалазин и фаллоидин тормозят те виды клеточной подвижности, которые связаны с агрегацией и диссоциацией нитей актина. Цитохалазин ингибирует сборку, а фаллоидин - распад микрофиламентов.
В клетках эукариот имеются микротрубочки, которые поддерживают архитектуру клетки, а также участвуют в сократительной активности. Микротрубочки представляют собой полые фибриллы диаметром 240 А; они построены из тубулина. Реснички и жгутики клеток эукариот содержат девять двойных микротрубочек, окружающих две
одинарные. Между внешними парами микротрубочек имеются поперечные мостики из динеина - белка, обладающего АТРазной активностью. Индуцированное динеином скольжение прилегающих пар микротрубочек относительно друг друга вызывает из гиб реснички или жгутика; этот механизм лежит в основе биения ресничек и движения жгутиков. Ингибитором подвижности, опосредованной микротрубочками, служит колхицин, который блокирует их полимеризацию.