БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 12. МЕТАБОЛІЗМ ВУГЛЕВОДІВ
12.1.Катаболічні перетворення вуглеводів
12.1.2.Регуляція вмісту глюкози крові
Рівень концентрації глюкози у крові є по суті інтегральним показником рівня вуглеводного обміну в цілому, який є головним в обміні речовин в організмі тварин. Тому й контролюється метаболізм вуглеводів різними механізмами регуляції, які тісно координовані та взаємопов'язані. Насамперед, це регуляторна (глікогенна) функція печінки - відносно давній в еволюційному плані та простий механізм, що забезпечує регуляцію вуглеводного обміну в нижчих тварин, але недостатній для контролю метаболізму вуглеводів в організмі високорозвинених тварин і людини. Тому в процесі еволюції був сформований складніший механізм нейрогуморальної регуляції, який впливає як на регуляторну функцію печінки, так і на здатність інших тканин до утилізації глюкози.
Регуляторна функція печінки пов'язана з функціонуванням механізму утилізації надлишку глюкози, точніше, глюкозо-6-фосфату, перетворення його в компактну мобільну форму метаболічної енергії - глікоген і мобілізації цієї енергії в разі потреби у формі вільної глюкози.
Визначальну роль у регуляції обміну глікогену в печінці відіграє рівень концентрації глюкози. Висока концентрація глюкози в гепатоцитах приводить до стабілізації неактивної форми фосфорилази глікогену й до активації глікогенсинтази - головних ферментів обміну глікогену, що викликає гальмування фосфоролізу глікогену і стимуляцію його синтезу.
Перетворення глюкозо-6-фосфату на шляху синтезу глікогену здійснюється кількома послідовними ферментативними реакціями за такою схемою:
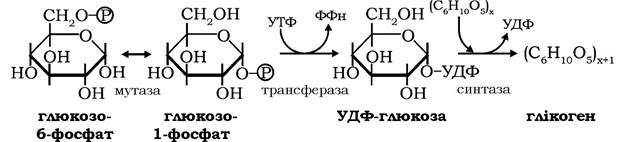
Спочатку в реакції за участю фосфоглюкомутази глюкозо-6- фосфат оборотно ізомеризуються на глюкозо-1 -фосфат, який за дії глюкозо-1-фосфатуридилтрансферази в реакції з УТФ трансформується в активовану форму глюкози - уридиндифосфатглюкозу. Реакція є необоротною, оскільки пірофосфат, котрий відщеплюється від УТФ, гідролізується пірофосфатазою до ортофосфату, і за рахунок енергії гідролізу синтезується УДФ-глюкоза.
У завершальній реакції біосинтезу глікогену перенесення глікозильного залишку від УДФ-глюкози на нередукуючий кінець полісахаридного ланцюга молекули глікогену каталізується глікогенсинтазою (УДФ-глікогентрансферою), яка утворює новий
α-1,4-глікозидний зв'язок між атомами вуглецю-1 глікозильного залишку УДФ-глюкози та вуглецю-4 кінцевого глікозильного залишку молекули глікогену.
Включення одного глікозильного залишку в молекулу глікогену спряжене з гідролізом двох γ-фосфатних груп молекул АТФ і УТФ. Коли довжина лінійного ланцюга молекули глікогену досягає 10 глікозильних залишків, його фрагмент із 6-7 залишків переноситься аміло-1,4-1,6-трансглікозилазою (фермент розгалуження) на інший ланцюг з утворенням а-1,6-зв'язку (тобто точки розгалуження) і нової гілки молекули (рис. 12.1). Далі глікогенсинтаза продовжує приєднання нових глікозильних залишків. Біохімічна логіка розгалуження полягає в підвищенні компактності молекули та збільшені кількості її нередукуючих кінців, що сприяє ефективній дії ферментів обміну глікогену - фосфорилази і глікогенсинтази.
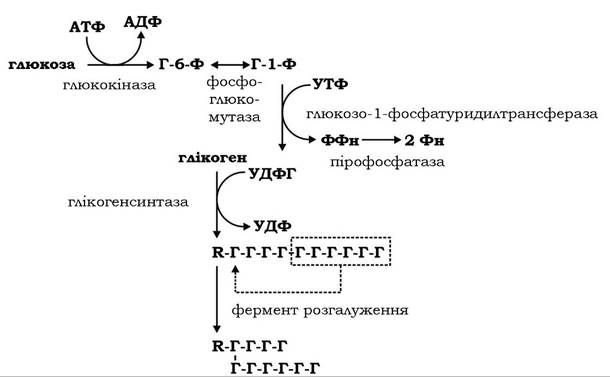
Рис. 12.1. Схема синтезу глікогену
За звичайних умов у клітинах практично завжди присутня деяка кількість полісахаридних ланцюгів глікогену, які слугують акцепторами нових глікозильних залишків, а за екстремальних (голодування протягом 24 год, виснажлива фізична праця) запаси глікогену в печінці можуть бути повністю вичерпані. У таких випадках ініціаторами, тобто первинними акцепторами нових глікозильних залишків, слугують поліпептидні ланцюги, на яких спочатку синтезуються праймерні олігосахариди і вже на них будуються полісахаридні ланцюги молекули глікогену (рис. 12.2).

Рис. 12.2. Схема біосинтезу глікогену на поліпептидних ланцюгах
У печінці дорослої людини середньої ваги (70 кг) може депонуватися близько 100 г глікогену, що становить 3-5 % від усієї маси органу. Ще 250-300 г цього поліглюкану може накопичуватися у м'язовій тканині, де також проходять розглянуті вище реакції біосинтезу глікогену з глюкози, яка надходить у клітини м'язів із крові. Але у функціональному відношенні глікоген м'язів, котрий становить 0,5-1,0 % маси тканини, відмінний від глікогену печінки, оскільки слугує постачальником енергії для скорочення м'язів.
Мобілізація глікогену в печінці відбувається зазвичай у постабсорбтивний період, коли виникає потреба тканин у глюкозі. Розпад глікогену здійснюється за сумісної дії трьох ензимів: глікогенфосфорилази, оліготрансферази і аміло-1,б-глюкозидази (рис. 12.3).
Фосфорилаза каталізує відщеплення глікозильних залишків у формі глюкозо-1-фосфату (Г-1-Ф), починаючи від периферійного кінця зовнішніх гілок. При наближенні до точки розгалуження фермент зупиняється, даючи можливість оліготрансферазі перебудувати редуковану фосфорилазою полісахаридну гілку глікогену й оголити глікозильний залишок, приєднаний а-1,6-зв'яз- ком. Після гідролізу цього зв'язку ферментом аміло-1,б-глюкозидазою продовжується фосфороліз а-1,4-глікозидних зв'язків уздовж наступного поліглікозидного ланцюга молекули глікогену до нової точки розгалуження. Молекули глюкозо-1-фосфату, які вивільнюються під час фосфоролізу глікогену, за участю фосфоглюкомутези ізомеризуються в глюкозо-6-фосфат.
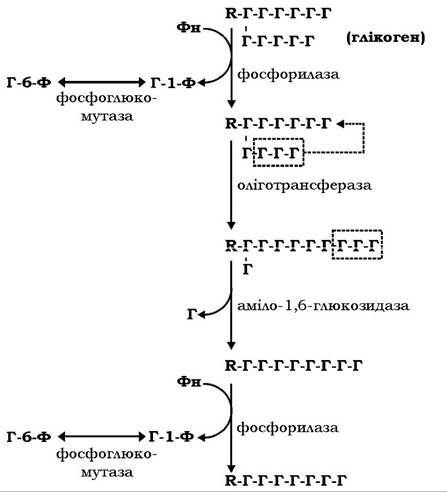
Рис. 12.3. Схема реакцій фосфоролізу глікогену
Отже, більша частина (до 90 %) глікогену печінки розщепляється фосфоролітично, а значно менша частина (близько 10 % а-1,6-зв'язків) зазнає гідролітичного розщеплення. Слід зауважити, що гідроліз глікогену відбувається головним чином у шлунково-кишковому тракті під дією специфічних гідролаз.
Для глюкозо-6-фосфату - одного з головних проміжних метаболітів - можливі декілька альтернативних варіантів перетворень, і домінування якогось одного з них зазвичай зумовлено тимчасовими потребами як самої печінки, так і організму в цілому. По-перше, глюкозо-6-фосфат може дефосфорилюватися за участю глюкозо-6-фосфатази, яка присутня у клітинах печінки, а також нирок і кишечнику, до вільної глюкози, котра вивільнюється у кров у разі зниження її вмісту в крові. По-друге, глюкозо- 6-фосфат може розщеплюватися в реакціях гліколізу до пірувату та продуктів його окисного декарбоксилювання - ацетил-S-КоА і СО2, які разом із проміжним метаболітом гліколітичного шляху - дигідроксіацетонфосфатом можуть використовуватися для синтезу триацилгліцеролів, фосфоліпідів і холестеролу. І, по-третє, глюкозо-6-фосфат може зазнавати прямого окиснення на пентозофосфатному шляху з утворенням рибозо-5-фосфату та інших пентозофосфатів, а також відновних еквівалентів у формі НАДФН для відновних реакцій біосинтезу різних макромолекул, зокрема для синтезу нуклеотидів і нуклеїнових кислот.
Вирішальну роль у мобілізації глікогену відіграє глікогенфосфорилаза, яка є регуляторним ферментом. Її активність регулюється двома молекулярними механізмами - ковалентною модифікацією (фосфорилюванням) і алостерично.
Ковалентна модифікація молекули ферменту, що складається з двох ідентичних субодиниць, пов'язана з фосфорилюванням залишків серину-14 в обох субодиницях. За дії двох специфічних ферментів - цАМФ-залежної кінази фосфорилази і фосфатази фосфорилази здійснюються взаємоперетворення двох форм глікогенфосфорилази: неактивної фосфорилази в і активної фосфорилази а. Фосфорилаза в перетворюється на фосфорилазу а за участю цАМФ-залежної кінази фосфорилази, а фосфатаза фосфорилази каталізує оборотний перехід активної фосфорилази а в неактивну форму в:
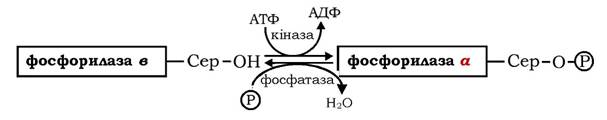
Швидкість мобілізації глікогену регулюється співвідношенням активної фосфорилази а і неактивної фосфорилази в. Другий механізм регуляції фосфорилази глікогену характерний для м'язів. М'язова неактивна фосфорилаза в може активуватися в результаті нековалентного зв'язування з алостеричним модулятором - АМФ, який змінює конформацію молекули ферменту. За місце зв'язування з АМФ конкурує АТФ і глюкозо-6-фосфат - алостеричні інгібітори ферменту. Отже, активність фосфорилази в у м'язах визначається співвідношенням АТФ до АМФ. У стані спокою при великому співвідношенні АТФ / АМФ фермент перебуває в неактивній формі. Під час скорочення м'язів, яке супроводжується розщепленням АТФ, концентрація АМФ у м'язах підвищується, змінюючи співвідношення цих нуклеотидів і, відповідно, активність фосфорилази в. На відміну від АМФ-залежної фосфорилази в фосфорилаза а м'язової тканини є АМФ-незалежною формою (рис. 12.4).
Фермент може існувати в каталітично неактивній формі в або в активній конформації а. Обидві субодиниці фосфорилюються по залишках серину-14 за дії кінази фосфорилази, яка стимулюється іонами Са2+. Необхідно зауважити, що фосфорилаза печінки також регулюється шляхом алостеричної модуляції глюкозою, яка є для неї алостеричним інгібітором.
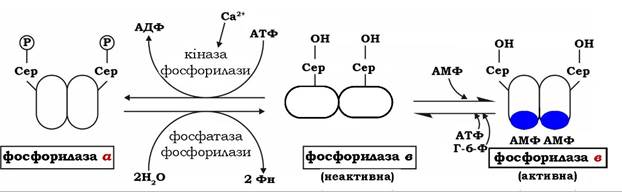
Рис. 12.4. Схема регуляції глікогенфосфорилази у м'язах
Нейрогуморальний механізм регуляції обміну глікогену складається нейроендокринними структурами гіпоталамуса й гіпофіза, а також периферійними ендокринними залозами - клітинами острівців Лангерганса підшлункової залози, щитоподібної та надниркової залоз, які швидко та ефективно реагують на будь-які зміни рівня глюкози в загальному кровообігу.
Першими на зміни вмісту цукру в крові реагують метаболічні центри гіпоталамуса й довгастого мозку, які за допомогою нервових імпульсів і тропних гормонів аденогіпофіза (кортикотропіну й соматотропіну) стимулюють периферійні ендокринні залози, які відкликаються на стимуляцію вивільненням у кров відповідних гормонів. Це, насамперед, глюкагон та інсулін - пептидні гормони, що синтезуються а- і β-клітинами острівців Лангерганса підшлункової залози, адреналін і норадреналін - гормони- аміни мозкового шару надниркової залози, кортикостероїди, котрі синтезуються в корковому шарі надниркової залози, а також тироксин - гормон щитоподібної залози. Гормональна регуляція вмісту глюкози в крові базується на антагоністичних взаємовідносинах між "діабетогенними" гормонами - групою гормонів, що сприяють підвищенню рівня глюкози крові та інсуліном -єдиним гормоном, який має виразний гіпоглікемічний ефект. Інсулін сприяє поглинанню глюкози гепатоцитами та інсулінозалежними клітинами жирової тканини й скелетних м'язів. У гепатоцитах інсулін стимулює індукцію глюкокінази, активність фосфодіестерази циклонуклеотидів і глікогенсинтази, що приводить до посилення біосинтезу глікогену.
Регулююча дія гормонів на обмін глікогену здійснюється шляхом модуляції активності ключових ферментів: глікогенсинтази і глікогенфосфорилази. Їхня активність регулюється реципрокно, тобто таким чином, що коли один із них, наприклад фосфорилаза, перебуває в неактивному стані, інший (глікогенсинтаза) виявляє повну активність і навпаки. У даному випадку одночасні протилежно спрямовані зміни активності цих ферментів здійснюються шляхом ковалентної модифікації - фосфорилювання- дефосфорилювання активних центрів глікогенсинтази та фосфорилази глікогену.
Дія глюкагону й адреналіну в печінці опосередкована специфічними рецепторами, розташованими на плазматичній мембрані гепатоцитів. Тип рецептора визначає молекулярний механізм передачі гормонального сигналу. Так, зв'язування гормонів з αι-рецепторами активує інозитолфосфатний механізм, а взаємодія з Рг-рецепторами стимулює аденілатциклазну систему внутрішньоклітинної передачі інформації (рис. 12.5).
При зв'язуванні гормонів глюкагону або адреналіну зі специфічними рецепторами плазматичних мембран гепатоцитів або міоцитів і утворенні гормонорецепторного комплексу відбувається стимуляція аденілатциклази (Ац) або фосфоліпази С (ФЛС). Результатом цієї стимуляції буде швидке підвищення вмісту внутрішньоклітинних посередників - цАМФ або 1,2-діацилгліцеролу (ДАГ) та інозитол-1,4,5-трифосфату (І-1,4,5-Ф) на 2-3 порядки над їхнім базальним рівнем. Ці посередники активують протеїн- кіназу шляхом алостеричної модуляції (цАМФ, цГМФ), або Са2+- залежним механізмом (С-кіназа)
Циклонуклеотидзалежна протеїнкіназа, яка складається з чотирьох субодиниць - двох регуляторних і двох каталітичних, у присутності цАМФ (цГМФ) оборотно дисоціює зі звільненням каталітичних субодиниць. Активована таким чином протеїнкіназа, у свою чергу, фосфорилює кіназу фосфорилази і глікоген-синтазу, що приводить до активації фосфорилази та одночасного гальмування глікогенсинтазної активності.
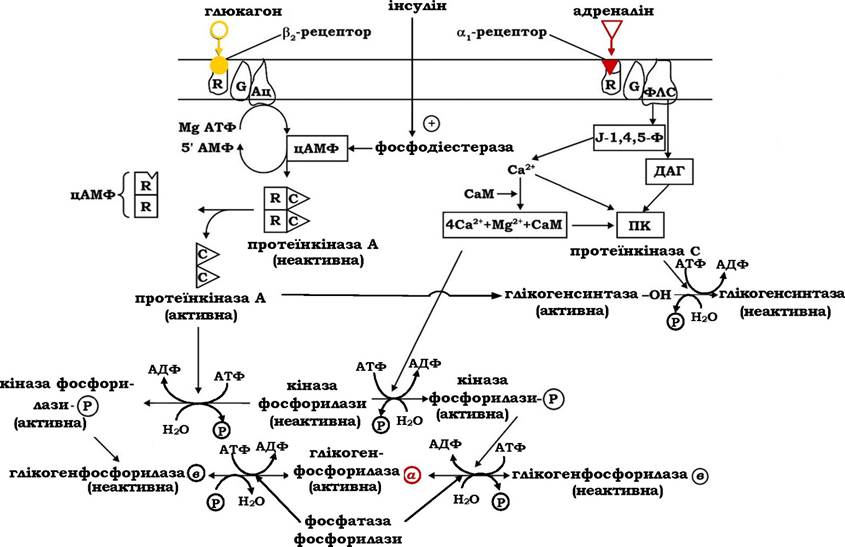
Рис. 12.5. Регуляція фосфоролізу глікогену глюкагоном і адреналіном
При припиненні стимуляції аденілатциклази з боку адреналіну або глюкагону фермент переходить у неактивний стан і високий рівень цАМФ у клітині знижується до базального за дії фосфодіес- терази. Цитозольний фермент фофодіестераза циклічних нуклео- тидів активується інсуліном, який таким чином зупиняє перебіг ферментативних реакцій каскаду підсилення гормональних сигналів, які стимулюють фосфороліз глікогену. Дефосфорилювання ферментів здійснюється за участю фосфатаз, які каталізують гідроліз фосфорильних груп в активних центрах кінази фосфорилази, глікогенфосфорилази, а також глікогенсинтази, що перетворює активну кіназу фосфорилази та фосфорилазу а в неактивні форми, а також активує глікогенсинтазу.
Взаємодія адреналіну з αι-рецепторами й утворення гормоно-рецепторного комплексу активує фосфоліпазу С, яка каталізує гідроліз фосфатидилінозитолдифосфату плазматичних мембран з вивільненням інозитол-1,4,5-трифосфату і 1,2-діацилгліцеролу, котрі виконують функції вторинних посередників в інозитолфосфатному механізмі проведення гормонального сигналу (рис. 12.5).
Інозитолтрифосфат активує вивільнення з ендоплазматичного ретикулума іонів Са2+, які разом з 1,2-діацилгліцеролом активують Са2+, фосфоліпідзалежну протеїнкіназу (кіназу С). Крім того, збільшення концентрації іонізованого кальцію в цитоплазмі сприяє утворенню комплексу катіона з Са2+-зв'язувальним білком - каль-модуліном (CaM), який набуває здатності регулювати активність Са2+-залежних ферментів. Активація кінази фосфорилази і каль-модулінзалежних протеїнкіназ приводить до фосфорилювання глікогенфосфорилази в і перетворення її в активну форму а, а також глікогенсинтази, що переводить її в неактивний стан.
Отже, функціонування молекулярного механізму, який забезпечує координований синтез і розпад глікогену, базується на реакціях фосфорилювання-дефосфорилювання залишків серину в активних центрах ферментів обміну глікогену. В організмах вищих тварин і людини цей механізм контролюється нейрогуморальною регуляторною системою.
Глюкагон викликає прискорення фосфоролізу глікогену в печінці й не впливає на його розщеплення у м'язах. Стресовий гормон адреналін стимулює фосфороліз глікогену та блокує його синтез у печінці, скелетних м'язах і міокарді. Регуляція метаболізму глікогену в м'язах забезпечується молекулярними механізмами двох типів: ковалентною модифікацією та алостеричною модуляцією.
Дефіцит інсуліну в організмі приводить до розвитку системного захворювання - цукрового діабету, який характеризується послабленням біосинтезу й депонування глікогену в тканинах, активацією фосфоролізу глікогену в печінці та скелетних м'язах, підвищенням мобілізації жирних кислот в адипоцитах і розщеплення тканинних білків. Високий ступінь глікозилювання білків, зокрема гемоглобіну, що спостерігається при розвитку цього захворювання, веде до порушення їхніх функцій. Тому основними характерними симптомами цукрового діабету є гіперглюкоземія, азотемія, гіперліпідемія, що є наслідком системних порушень метаболізму вуглеводів, білків, ліпідів в організмі хворих.
Спадкові порушення обміну глікогену - глікогенози - зумовлені відсутністю або нестачею деяких ферментів, що беруть участь у реакціях його синтезу або розпаду. Так, відсутність глюкозо-6- фосфатази в печінці приводить до накопичення надзвичайно великої кількості глікогену (хвороба Гірке) на фоні вираженої гіпоглікемії, що спостерігається в постабсорбтивний період. При деяких глікогенозах у тканинах хворих синтезуються аномальні за структурою глікогени як з редукованими боковими гілками внаслідок відсутності аміло-1,6-глюкозидази (хвороба Корі), так і з довгими малорозгалуженими ланцюгами у разі нестачі аміло-1,4- 1,6-трансглікозилази (хвороба Андерсена).
Глікогенози, пов'язані з нестачею глікогенсинтази в печінці хворих (хвороба Льюїса), приводять до значного зменшення вмісту глікогену в органі, що супроводжується тривалою гіперглікемією в абсор- бтивний період і гіпоглікемією в постабсорбтивний проміжок часу. За відсутності фосфорилазної активності в м'язах (синдром Мак- Ардля) хворі не здатні виконувати інтенсивну фізичну роботу через нестерпні м'язові судоми. Деякі глікогенози мають більш серйозні симптоми, що приводять до тяжких наслідків (наприклад, хвороба Гірке) і навіть до летального кінця в ранньому віці (хвороба Помпе - відсутність лізосомної α-1,4-глюкозидази; хвороба Андерсена).