БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 16. ЕНЕРГЕТИЧНИЙ ОБМІН
16.1.Біологічне окиснення
16.1.3.Ферменти й коферменти, які беруть участь в окисно-відновних реакціях
Перенесення електронів від субстратів, що окиснюються, до кисню відбувається в кілька етапів. У ньому бере участь велика кількість проміжних переносників, кожний з яких здатний приєднувати електрони від попереднього компонента й передавати наступному. Так виникає ланцюг окисно-відновних реакцій, у результаті чого відбуваються відновлення О2 і синтез Н2О. У дихальний ланцюг мітохондрій входить велика кількість переносників (рис. 16.4).
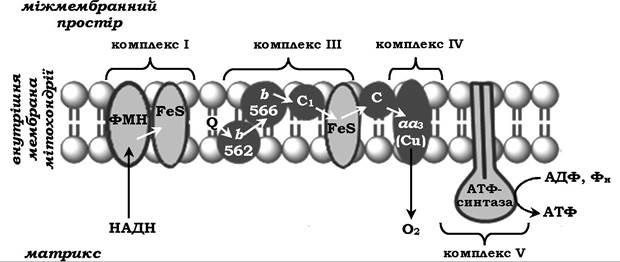
Рис. 16.4. Мітохондріальний ланцюг перенесення електронів:
Комплекс І містить ФМН не менше п'яти залізосірчаних білків (FеS).
Комплекс ІІІ включає дві різні форми цитохрому b (з максимумом поглинання 562 і 566), один FеS-білок.
Комплекс ІV містить цитохроми а1 і а3 та два іони міді. Комплекс V - АТФ-синтаза.
Цитохром с є поверхневим білком і не входить до комлексів.
Комлекс ІІ на рисунку не показано
За винятком убіхінону (коферменту Q (KoQ)), усі компоненти ЛПЕ - білки. У їхньому складі містяться різні небілкові компоненти: ФМН, Fe у складі залізосірчаних білків і в складі порфіринових кілець, іони Сu.
Первинні акцептори водню окисно-відновних реакцій відносять до двох типів дегідрогеназ: нікотинамідзалежні, що містять як коферменти похідні нікотинової кислоти, та флавінозалежні, які мають у своєму складі похідні рибофлавіну.
Нікотинамідзалежні дегідрогенази містять як коферменти НАД+ або НАДФ+. Ці коферменти входять до складу активних центрів дегідрогеназ, але можуть оборотно дисоціювати з комплексу з апоферментами та включатись до складу ферменту в ході реакції. Субстрати НАД- і НАДФ-залежних дегідрогеназ знаходяться в матриксі мітохондрій і в цитозолі. Робочою частиною нікотинамідних коферментів слугує нікотинамід (рис. 16.5).

Рис. 16.5. Структурні формули робочої частини коферментів НАД+ і НАДФ+:
в окисненій формі никотинамідні коферменти позначають як НАД+ і НАДФ+,
оскільки вони мають позитивний заряд на атомі азоту піридинового кільця.
У реакціях дигідрування з двох атомів водню, які відщеплюються від субстрату, що окиснюється, никотинамідне кільце приєднує іон водню і два електрони у формі гідрид-іона (:Н-). Другий іон переходить у середовище. В оборотній реакції НАДН (НАДФН) є донором електронів і протонів
Більшість дегідрогеназ, які поставляють електрони в ЛПЕ, містять НАД+. Вони каталізують реакції типу
![]()
Отже, НАД+, приєднуючи протони та електрони від різних субстратів, слугує головним колектором енергії речовин, що окис- нюються, і головним джерелом електронів з високим енергетичним потенціалом для ЛПЕ.
НАДФН не є безпосереднім донором електронів у ЛПЕ, він використовується у відновних біосинтезах. Однак можливе включення електронів з НДДФН у ЛПЕ завдяки дії піридиннуклеотидтрансгідрогенази, яка каталізує реакцію
![]()
Флавінові дегідрогенази містятьяк коферменти ФАД або ФМН, які утворюються в організмі людини з вітаміну B2. Флавінові коферменти міцно зв'язані з апоферментами. Робочою частиною ФАД і ФМН є ізоалоксазинова сполучена циклічна система (рис. 16. 6).
ФАД слугує акцептором електронів від багатьох субстратів у реакціях типу
![]()
де Е - білкова частина ферменту.

Рис. 16.6. Структурні формули робочої частини коферментів ФАД і ФМН:
у ході реакції ФАД і ФМН приєднують два електрони і, на відміну від НАД+, два протони, що втрачаються субстратом
Більшість ФАД-залежних дегідрогеназ є розчинними білками, які локалізовані в матриксі мітохондрій. Виключенням є сукцинатдегідрогеназа, що міститься у внутрішній мембрані мітохондрій. До ФМН-вмістних ферментів належить НАДН-дегідрогеназа, яка також локалізована у внутрішній мембрані мітохондрій; вона окиснює НАДН, що утворюється в мітохондріальному матриксі.
Ланцюг перенесення електронів від НАДН і ФАДИ на кисень. Перенесення електронів від НАДН до О2 включає ряд переносників, локалізованих у внутрішній мембрані мітохондрій. За винятком убіхінону й цитохрому с, це складні білкові комплекси.
НДДН-дегідрогеназа (НАДН-Р-редуктаза, комплекс I) складається з декількох поліпептидних ланцюгів. Роль простетичної групи виконує ФМН. Єдиний субстрат ферменту - НАДН, з якого два електрони і протон переносяться на ФМН з утворенням ФМНН2. Другий протон поглинається з матриксу. Реакція проходить за рівнянням
![]()
З ФМНН2 електрони переносяться потім на ряд залізо- сірчаних білків (Fe), що виконують роль другої простетичної групи в молекулі НАДН-дегідрогенази. Атоми заліза в цих білках (не- гемове залізо) зібрані в кілька груп, так званих залізо-сірчаних центрів. FeS-центри утворюють комплекси з багатьма білками (флавопротеїнами, цитохромами), які беруть участь в окисно- відновних реакціях. Відомі три типи FeS-центрів (Fe, Fe2S2, Fe4S4), в яких атом заліза зв'язаний з атомом сірки залишків цистеїну або неорганічної сірки.
У НАДН-дегідрогеназі є кілька центрів типу Fe2S2 і Fe4S4. Атоми заліза в таких центрах можуть приймати і віддавати електрони по черзі, переходячи у феро- (Fe2+) і фери- (Fe3+) стани. Від залізосірчаних центрів електрони переносяться на кофермент Q (убіхінон) (рис. 16.7).
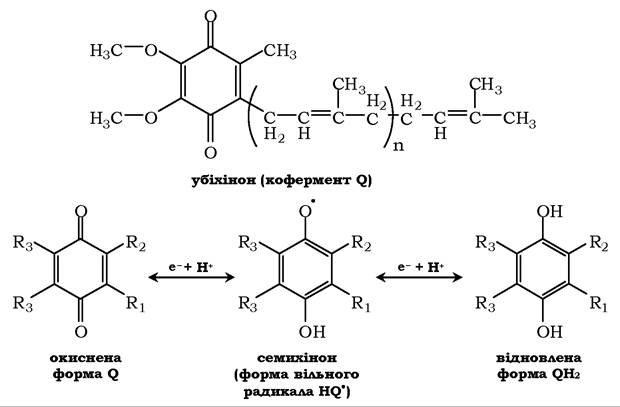
Рис. 16.7. Структура убіхінону (коферменту Q): n - кількість ізопреноїдних ланок (n = 6-10).
Убіхінон може приймати один електрон і перетворюватися в семихінон або два електрони й повністю відновлюватися в гідрохінон (убіхінол)
Позначення цього жиророзчинного хінону походить від першої букви англійської назви хінону (quinone), а назва убіхінон відображає його поширеність у природі (ubiquitous - усюди розповсюджений). Молекули убіхінону залежно від джерела, з якого вони виділені, різняться довжиною вуглеводневого ланцюга, який у ссавців містить десять ізопреноїдних ланок і позначається як Q10. У процесі перенесення електронів з НАДН-дегідроге- нази через Fe на убіхінон він оборотно перетворюється в гідрохінон. Убіхінон виконує колекторну функцію, приєднуючи електрони від НАДН-дегідрогенази та інших флавінзалежних дегідрогеназ, зокрема від сукцинат-дегідрогенази. Убіхінон бере участь у реакціях типу
![]()
Цитохроми, або гемопротеїни, присутні в усіх типах організмів. У клітинах еукаріотів вони локалізовані в мітохондріальних мембранах і в ендоплазматичному ретикулумі. Відомо близько 30 різних цитохромів. Усі вони як простетичну групу містять гем. Їхнє різноманіття зумовлене різницею:
✵ бічних ланцюгів у структурі гему;
✵ у структурі поліпептидних ланцюгів;
✵ у способі зв'язку поліпептидних ланцюгів з гемом.
Залежно від здатності поглинати світло у визначеній частині
спектра всі цитохроми поділяють на групи а, b, с. Усередині кожної групи окремі види з унікальними спектральними властивостями позначають цифровими індексами (b1, b2 і т. д.).
Структурні особливості різних виглядів цитохромів визначають розходження в їхніх окисно-відновних потенціалах. У ЛПЕ беруть участь шість типів цитохромів (а, а3, b1, b2, с, с1). За винятком цитохрому с, усі вони містяться у внутрішній мембрані міто- хондрій у вигляді складних білкових комплексів (табл. 16.3).
QH2-дегідрогеназа (коензим Q-цитохром с-редуктаза, комплекс III) складається із двох типів цитохромів (b1 і b2) і цитохрому с1. QH2-дегідрогеназа переносить електрони від убіхінолу на цитохром с. Усередині комплексу III електрони передаються від цитохромів b на FeS-центри, далі на цитохром сі, а потім на цитохром с. Групи гему, подібно до FeS-центрів, переносять тільки по одному електрону. Таким чином, від молекули QH2два електрони переносяться на дві молекули цитохрому b. Як проміжний продукт у цих реакціях перенесення електронів можливе утворення вільного радикала семихінону. У цитохромах типу b гем не зв'язаний ковалентно з білком, а в цитохромах с1 і с він приєднується до білка за допомогою тіоефірних зв'язків. Ці зв'язки утворюються шляхом приєднання два цистеїнові залишки до вінільних груп гему.
Таблиця 16.3
Компоненти мітохондріального ланцюга перенесення електронів
Назва компонента |
Простетична група |
Донор електронів |
Акцептор електронів |
НАДН-дегідрогеназа, комплекс І |
ФМН, FeS |
НАДH |
KoQ |
Коензим Q, убіхінон |
Комплекс І |
Комплекс ІІІ (bc1) |
|
QН2-дегідрогеназа, комплекс ІІІ |
FeS, гем b1 (562), гем b2 (566), гем с1 |
QH2 |
Цитохром с |
Цитохром с |
Гем с |
Комплекс ІІІ |
Комплекс IV |
Цитохромоксидаза, комплекс ІV |
Гем а, а3, Cu2+ |
Цитохром с |
О2 |
Сукцинатдегідрогеназа, комплекс ІІ (безпосередньо не входить в ЛПЕ, що наведений на рис. 16.4.) |
ФАД, FeS |
Сукцинат |
KoQ |
Цитохром с - периферичний водорозчинний мембранний білок з молекулярною масою 12 500 Да, що має один поліпептид- ний ланцюг, який включає майже 100 амінокислотних залишків, і молекулу гему, що є ковалентно зв'язаною з поліпептидом.
Цитохромоксидаза (комплекс IV) складається з двох цитохро- мів типу а (а та аз), кожний із яких має центр зв'язування з киснем. Вони мають характерну залізопорфіринову простетичну групу, яка називається гемом а й відрізняється від гему цитохромів b, с і сі тим, що містить формільну групу замість однієї з метильних груп і вуглеводневу замість однієї з вінільних груп.
Іншою особливістю комплексу а-аз є наявність у ньому іонів міді, зв'язаних з білковою частиною в так званих центрах. Перенесення електронів комплексом а-аз включає реакції
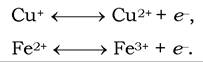
Комплекс цитохромів а-аз безпосередньо реагує з молекулярним киснем. Деякі характеристики компонентів ЛПЕ наведено в табл. 16.3.