БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
16. КООРДИНАЦИЯ И РЕГУЛЯЦИЯ У РАСТЕНИЙ
16.2. Ростовые вещества растений
16.2.6. Гиббереллины
Открытие гиббереллинов
В двадцатые годы прошлого века группа японских ученых Токийского университета исследовала заболевание всходов риса — «баканэ», или «болезнь дурных побегов», вызываемую грибом Gibberella fujikuroi (теперь этот гриб называют Fusarium moniliforme). Это заболевание наносило огромный ущерб сельскому хозяйству во всем мире. Зараженные растения сильно вытягивались в длину, обесцвечивались и в конечном итоге погибали или давали очень плохой урожай. К 1926 г. был получен экстракт гриба, который вызывал все эти симптомы. В 1935 г. было получено в кристаллическом виде первое активное соединение, а к 1938 г. — еще два. По названию гриба соединения были названы гиббереллинами. Языковый барьер, а затем вторая мировая война не позволили сразу оценить японское открытие в других странах, но уже в первые послевоенные годы между британскими и американскими учеными развернулось настоящее соревнование в попытках выделить эти вещества. В 1954 г. в Британии получили активное соединение, которое назвали гибберелловой кислотой. Она соответствовала третьему по счету, самому активному, гиббереллину японцев (ГК3). В пятидесятые годы XX в. выяснилось, что такие соединения присутствуют не только в грибах, но и в высших растениях, однако структурная формула ГК3 была окончательно установлена только в 1959 г. (рис. 16.18). Сейчас известно более 50 природных гиббереллинов, весьма похожих по строению на ГК3.

Рис. 16.18. Структурные формулы гиббанового скелета (вверху) и гибберелловой кислоты (ГК3) (внизу).
Строение гиббереллинов
Все гиббереллины относятся к терпенам — неоднородной группе веществ растительного происхождения, близкой к липидам; все они являются слабыми кислотами и содержат так называемый гиббановый скелет (рис. 16.18).
Синтез и распределение гиббереллинов
В наибольшем количестве гиббереллины содержатся в молодых активно растущих органах и синтезируются они прежде всего в молодых верхушечных (апикальных) листьях (возможно, в их хлоропластах), почках, семенах и кончиках корней. Затем из листьев они мигрируют неполярно, т. е. вверх или вниз по растению. Миграция осуществляется по флоэме и ксилеме.
Действие гиббереллинов
Подобно ауксинам, гиббереллины вызывают главным образом удлинение стебля в основном за счет растяжения его клеток. С их помощью можно восстановить нормальный рост у генетически карликовых сортов гороха и кукурузы и превратить карликовую фасоль во вьющуюся лиану (рис. 16.19), а также стимулировать рост обычных растений. Взаимодействия гиббереллинов и ауксинов рассматриваются в разд. 16.3.

Рис. 16.19. Влияние гибберемовой кислоты (ГК3) на рост карликового гороха сорта Метеор. Крайнее левое растение не обрабатывалось ГК3 и поэтому сохранило типичный карликовый габитус. Остальные растения получили разные дозы ГК3 (дозы в микрограммах указаны на табличках). Повышение дозы до 5 мкг усиливает рост стеблей.
Один из классических эффектов гиббереллинов, который изучали особенно интенсивно, пытаясь понять механизм их действия, — это прерывание покоящегося состояния некоторых семян, в частности злаков. Прорастание семян индуцируют, замачивая их в воде. Пропитавшийся водой зародыш секретирует гиббереллины, которые диффундируют в алейроновой слой, стимулируя там синтез определенных ферментов, в том числе α-амилазу (рис. 16.20). Эти ферменты катализируют расщепление запасных веществ эндосперма, а продукты его переваривания диффундируют в зародыш, где используются для его роста.
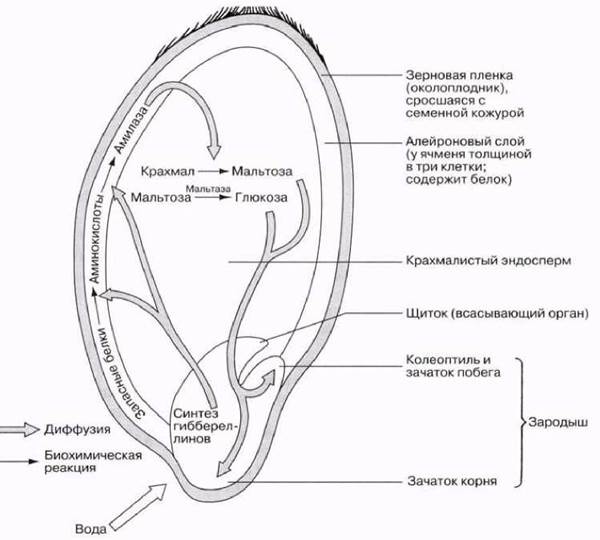
Рис. 16.20. Роль гиббереллина в мобилизации пищевых запасов зерновки ячменя во время прерывания ее покоя.
16.13. а) Какое вещество служит субстратом для α-амилазы?
б) Каковы продукты катализируемой этим ферментом реакции?
в) Какой еще фермент необходим для расщепления субстрата α-амилазы до мономеров?
г) Почему α-амилаза так важна для прорастания семян зерновых?
16.14. Объясните роль запасных белков алейронового слоя, ориентируясь на рис. 16.20.
Опыт 16.2. Проверка двух гипотез:
а) что гиббереллин стимулирует расщепление крахмала в прорастающих зернах ячменя;
б) что гиббереллин образуется в зародыше
Присутствие амилазы в зернах ячменя можно установить, поместив половинку зерна поверхностью среза на влажный агар, содержащий крахмал. Амилаза будет диффундировать в агар и катализировать расщепление крахмала. Если затем на поверхность агара поместить каплю иода, то нерасщепленный крахмал окрасится в сине-черный цвет, а вокруг семени останется светлая зона, размеры которой примерно коррелируют с количеством выделившегося из зерна фермента. При постановке опыта очень важно соблюдать стерильные условия, поскольку попавшие на агар грибы и бактерии также могут выделять амилазу.
Точное соблюдение описанной ниже методики позволит проверить и другие гипотезы (см., например, Coppage J., Hill Т. А. (1973), J. Biol. Ed., 7,11-18).
Материалы и оборудование (в расчете на одного учащегося)
Белая кафельная плитка
Скальпель
Пинцет
Мерный стакан на 50 мл
Наклейки или фломастер
Раствор иода в йодистом калии
Стерильная дистиллированная вода в стерильных колбах (3 шт.)
5 %-ный раствор гипохлорита натрия или фирменная стерилизующая жидкость (например, жидкость Милтона), или 70%-ный спирт
Две чашки с агаром и крахмалом (стерильные): 1 %-ный раствор агара, содержащий 0,5% крахмала, заливают в стерильные чашки Петри слоем толщиной около 0,25 см
Две чашки с агаром, содержащим крахмал и гиббереллин: готовятся, как указано выше, но перед автоклавированием к агару добавляют гиббереллин (ГКз) из расчета 1 мл 0,1%-ного раствора ГКз на 100 мл агара (конечная концентрация ГК3 составляет 10 млн-1). Гиббереллин плохо растворим в воде, а лучше всего растворяется в этаноле; некоторое количество ГКз разрушается при автоклавировании, но семена чувствительны к гиббереллину даже в концентрации до 10-5 млн-1.
Лущеные зерновки ячменя: чтобы очистить семена от пленки, их вымачивают 3—4 ч в 50%-ном (О/О) водном растворе серной кислоты, затем тщательно промывают (до десяти раз) в дистиллированной воде; сильное встряхивание зерен в конической колбе позволяет удалить практически всю пленку; после этого семена надо использовать немедленно, поскольку замачивание индуцирует их прорастание. Можно также разделить семена на «зародышевую» и «незародышевую» половины (см. ниже) и хранить их в сухих условиях в холодильнике не более 2—3 суток. Вместо семян ячменя можно использовать семена пшеницы, поскольку они голые и не требуют лущения.
Методика
1. Возьмите две чашки с крахмальным агаром и две чашки с агаром, содержащим крахмал и гиббереллин и пометьте их соответственно +ГК и —ГК. Чашки должны быть стерилизованы. Одну чашку в каждой паре подпишите «зародыш», другую — «без зародыша».
2. Разрежьте поперек по крайней мере два сухих зерна ячменя (рис. 16.21) на кафельной плитке; таким образом у вас получились «зародышевые» и «незародышевые» половины.

Рис. 16.21. Как следует разрезать зерно ячменя для опыта 16.2.
3. Простерилизуйте половины в 5%-ном растворе гипохлорита натрия в течение 5 мин. Затем трижды промойте стерильной дистиллированной водой в стерильных колбах.
4. С помощью пинцета, простерилизованного в 70%-ном спирте, положите половинки семян в соответствующие чашки Петри срезом вниз; старайтесь при этом как можно меньше приоткрывать крышки. Вы получите четыре варианта:
![]()
5. Чашки Петри инкубируют 24—28 ч при температуре 20—30 °С.
6. Для того чтобы выявить наличие крахмала, в каждую чашку на поверхность агара налейте раствор I2/КI. Зарисуйте внешний вид каждой чашки после пробы на крахмал. Обсудите полученные результаты.
16.15. При работе с агаром, содержащим крахмал, активность часто выявляется и в отпечатках пальцев. Как это можно объяснить?
16.16. Какой еще опыт можно поставить, используя те же материалы, чтобы доказать, что гиббереллины вызывают синтез именно новой амилазы, а не активацию уже существующей.
16.17. Как вы можете доказать, что синтез амилазы происходит в алейроновом слое?
16.18. Как можно использовать действие гиббереллина на семена ячменя для разработки биотеста на активность этого вещества?
Другие эффекты гиббереллинов
Влияние гиббереллинов на цветение, рост плодов и период покоя разных растительных структур, а также их связь с фотопериодизмом и яровизацией обсуждаются ниже в соответствующих разделах. Обобщенно их физиологические эффекты представлены в табл. 16.4.
Таблица 16.4. Влияние фитогормонов на рост и развитие растений
Затрагиваемый процесс |
Ауксины |
Гибберелпины |
Рост стеблей |
Стимулируют увеличение размеров клеток ниже апекса Стимулируют деление клеток камбия |
Стимулируют увеличение размеров клеток в присутствии ауксина Стимулируют деление клеток апикальной меристемы и камбия Стимулируют «выход в стрелку» у некоторых розеточных видов |
Рост корней |
Стимулируют в очень низких концентрациях Подавляют в более высоких концентрациях (геотропизм) |
Обычно неактивны |
Закладка корней |
Стимулируют образование корней у черенков и каллусов |
Подавляют |
Закладка почек (побегов) |
Стимулируют у некоторых каллусов, но иногда подавляют (антагонизм в отношении цитокининов). Иногда стимулируют у интактных растений, если нарушить апикальное доминирование (см. ниже) |
Стимулируют у каллуса хризантем Иногда стимулируют у интактных растений, если нарушить апикальное доминирование |
Рост листьев1 |
Неактивны |
Стимулируют |
Рост плодов |
Стимулируют. Иногда индуцируют партенокарпию |
Стимулируют. Иногда индуцируют партенокарпию |
Апикальное доминирование |
Стимулируют, т. е. подавляют рост боковых почек |
Усиливают действие ауксинов |
Покой почек1 |
Неактивны |
Прерывают |
Покой семян1 |
Неактивны |
Прерывают (например, у зерновых, ясеней) |
Цветение1 |
Обычно неактивны (стимулируют у ананаса) |
Иногда замещают красный свет, т. е. стимулируют у длиннодневных видов и подавляют у короткодневных |
Старение листьев |
Задерживают у некоторых видов |
Задерживают у некоторых видов |
Созревание плодов |
— |
— |
Опадение органов |
Подавляют. Иногда стимулируют, если опадение уже началось, или если их наносить со стороны отделительного слоя, обращенной к стеблю |
Неактивны |
Влияние на устьица |
Неактивны |
Неактивны |
Затрагиваемыйпроцесс |
Цитокинины |
Абсцизоваякислота |
Этилен |
Рост стеблей |
Стимулируют клеточные деления апикальной меристемы и камбия. Иногда подавляют растяжение клеток |
Подавляют, особенно при физиологическом стрессе, например засухе, переувлажнении |
Подавляет, особенно при физиологическом стрессе |
Рост корней |
Неактивны или подавляют первичныйрост |
Подавляет (геотропизм?) |
Подавляет (геотропизм?) |
Закладка корней |
Неактивны или стимулируют рост боковых корней |
— |
— |
Закладка почек (побегов) |
Стимулируют, например у протонемы мхов |
— |
— |
Рост листьев1 |
Стимулируют |
— |
— |
Рост плодов |
Стимулируют. Изредка индуцируют партенокарпию |
— |
— |
Апикальноедоминирование |
Антагонисты ауксинов, т. е. стимулируют рост боковых ночек |
— |
— |
Покой почек1 |
Прерывают |
Стимулирует, например у берез, платанов |
Прерывает |
Покой семян1 |
Прерывают |
Стимулирует |
— |
Цветение1 Старениелистьев |
Обычно неактивны Задерживают |
Иногда стимулирует у короткодневных видов и подавляет у длиннодневных (антагонист гиббереллинов) Иногда стимулирует |
Стимулирует у ананаса |
Созревание плодов |
— |
— |
Стимулирует |
Опадениеорганов |
Неактивны |
Стимулирует |
— |
Влияние на устьица |
Стимулируетраскрытие |
Стимулирует закрывание в условиях водного стресса (увядание) |
Неактивен? |
1 Важны также свет и температура — см. разделы о фотопериодизме и яровизации. |
|||
ПРИМЕЧАНИЕ. В таблице представлены самые общие сведения. Ростовые вещества не всегда оказывают то действие, которое здесь указано; довольно обычны различия в реакции у разных растений. Однако основное внимание лучше обращать на характерные эффекты; они выделены жирным шрифтом и наиболее важны для учащихся. |
|||
Механизм действия гиббереллинов
Механизм действия гиббереллинов до сих пор неясен. Было установлено, что в семенах злаков ГК3 стимулирует синтез новых белков, в частности α-амилазы; при этом ГК3 эффективна в столь низких концентрациях (до 10-5 мкг/мл), что действует, вероятно, на таком глубоком уровне клеточного метаболизма, как «включение» и «выключение» генов, связанных с клеточной дифференцировкой (разд. 23.9). До настоящего времени, однако, убедительных подтверждений этого не получено, и к тому же другие эффекты требуют более высоких концентраций ГК3. Рост клеток растяжением гиббереллины стимулируют только в присутствии ауксинов.
Практическое применение гиббереллинов
В промышленных масштабах гиббереллины получают из культуры грибов. Эти фитогормоны стимулируют завязывание плодов и используются для выращивания бессемянного винограда. Иногда можно вызвать развитие таких плодов из неоплодотворенных завязей; это явление называется партенокарпией. ГК3 применяют в пивоварении для стимуляции образования α-амилазы у ячменя, т. е. для более эффективного осолаживания. Ряд синтетических веществ подавляет действие гиббереллинов и используется в качестве ретардантов, или ингибиторов роста. Обработка этими веществами приводит к развитию низкорослых (карликовых) растений с толстыми стеблями и темно-зелеными листьями, а иногда и с повышенной устойчивостью к вредителям и болезням. Занимая меньше места, такие экземпляры могли бы в принципе повысить урожайность культур с единицы площади. Кроме того, они менее склонны к полеганию.
Применение регуляторов роста растений
Большая часть регуляторов роста растений была открыта в ходе разработки и испытания гербицидов. Эффект таких веществ решающим образом зависит от их дозы и времени применения.
Агенты, повышающие продуктивность культур
1. Хлормеквата хлорид укорачивает и повышает жесткость пшеничной соломины, что препятствует ее полеганию и позволяет повысить дозу азотных удобрений.
2. Гибберелловую кислоту используют для стимуляции завязывания плодов у мандаринов и груш; для борьбы с потерями урожая яблок от заморозков; для увеличения размеров ягод у бескосточкового винограда, что позволяет продавать его в свежем виде, а не только в форме изюма; для повышения холодостойкости сахарного тростника на Гавайских островах.
3. Этефон (выделяет этилен) применяют для стимуляции истечения латекса у гевеи.
4. Глизофозин стимулирует вызревание сахарного тростника.
Агенты, повышающие качество продукции
1. Гибберелловая кислота (в сочетании с механическим прореживанием гроздьев) увеличивает размеры ягод у бессемянного винограда в Калифорнии.
2. Этилен устраняет зеленый цвет у плодов цитрусовых.
3. Гиббереллины задерживают созревание бананов, что способствует повышению их «лежкости».
Агенты, повышающие прибыль от урожая
1. Гибберелловую кислоту используют для ускорения или задержки созревания артишоков, что позволяет поднимать на них цену вне сезона массового сбора; для замедления созревания грейпфрутов с той же целью; для получения раннего урожая ревеня.
2. Гидразид малеиновой кислоты (ГМК) используют для продления срока хранения клубней и корнеплодов.
Ингибиторы роста (ретарданты)
1. Этефон (выделяет этилен) используют для укорачивания стеблей нарциссов при их выгонке, замедления роста и стимуляции ветвления томатов, гераней и роз.
2. Пипроктанила хлорид применяют для получения карликовых декоративных растений, в основном хризантем.
3. Дикегулак натрия замедляет рост живых изгородей, а также декоративных деревьев и кустарников.
Регуляторы роста растений используют также и для других целей, а именно:
1) стимуляции корнеобразования при вегетативном размножении растений;
2) прерывания или индукции периода покоя у семян, почек и запасающих органов;
3) контроля развития боковых стеблей (кущения);
4) повышения устойчивости к вредителям, неблагоприятным погодным условиям (например засухе) и загрязнению воздуха;
5) контроля размеров, формы и цвета продукции, выращиваемой для продажи в расфасованном виде;
6) подавления нежелательного вегетативного роста;
7) ускорения или задержки цветения и тем самым контроля завязывания и созревания плодов.
Рентабельность (отношение прибыли к затратам) применения гибберелловой кислоты для стимуляции завязывания плодов мандаринов составляет 9:1, для получения бескосточкового винограда — 40:1, а использование глизофозина повышает урожайность сахарного тростника на 10—15%. Однако, за исключением препаратов против полегания, регуляторы роста распространены слабо — главным образом в небольших специализированных хозяйствах. Некоторые из этих веществ, считавшиеся перспективными во время лабораторных испытаний, оказались ненадежными в полевых условиях. В результате практические достижения в этой области связаны главным образом с созданием новых гербицидов и пестицидов. Для дальнейшего применения регуляторов роста с целью улучшения свойств сельскохозяйственных культур, вероятно, потребуется разработка сбалансированных смесей из нескольких агентов.