Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 2. ТЕРМОДИНАМІКА БІОЛОГІЧНИХ ПРОЦЕСІВ ТА СИСТЕМ
2.3.Другий закон термодинаміки. Поняття ентропії
Перший закон термодинаміки вказує лише на факт збереження енергії, але не в напрямку, в якому можуть відбуватися термодинамічні процеси. Можливий напрямок термодинамічних процесів є предметом другого закону термодинаміки.
Другий закон термодинаміки дозволяє оцінювати здатність термодинамічної системи змінюватися в певному напрямку і визначати ефективність перетворення енергії в роботу. Найчастіше застосовується формулювання другого закону термодинаміки Рудольфа Клаузіуса (1850).
Другий закон термодинаміки. Теплота не може довільно переходити від холодного до більш нагрітого тіла.
Другий закон термодинаміки вказує на те, що всі реальні процеси (зокрема, в біологічних системах) супроводжуються перетворенням деякої частини енергії в теплоту. Всі форми енергії (механічна, хімічна, електрична тощо) можуть бути перетворені в теплову без залишку. Але сама теплота не може перетворюватися повністю в інші форми енергії. Не існує двигуна або процесу, який би перетворював теплову енергію в іншу форму енергії зі стовідсотковою ефективністю. Як відомо, розсіяння теплоти означає енергетичне розкладання [80]. Теплота - це деградована форма енергії, оскільки термічний рух молекул є хаотичним та ймовірнісним процесом. Таким чином, енергетичне розсіювання у формі теплоти необоротне.
Згідно з другим законом термодинаміки кожен реальний процес, що відбувається в термодинамічній системі, може відбуватися тільки в одному напрямку. Процес, за якого як система, так і навколишнє середовище поверталися б в їх первинні стани, неможливий. Будь-який реальний процес є тією чи іншою мірою необоротним.
Такою термодинамічною функцією системи є ентропія .
Напрямлення спонтанних процесів в ізольованих системах характеризується параметром стану, який називають ентропією S (з давньогрец. έντροπία - повернення, перетворення). Зміна ентропії системи dS визначається відношенням теплоти dQ, яка вводиться в систему або виводиться з неї, до абсолютної температури T системи, за якої цей процес відбувається: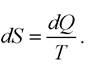
За нескінченно малих змін стану замкненої системи зміну ентропії виражають так:![]() .
.
В ізольованій термодинамічній системі зміна ентропії: dS > 0, де знак рівності відповідає циклічним оборотним процесам, а знак більше - реальним спонтанним необоротним процесам. Фактично цей вираз є математичним записом другого закону термодинаміки. Відповідно до цього закону в ізольованій системі ентропія зберігає стале значення для оборотних процесів (S = const), але вона завжди збільшується під час необоротних процесів і досягає максимуму за термодинамічної рівноваги (S → max). За другим законом термодинаміки усі необоротні процеси відбуваються в напрямку зростання ентропії. Ентропія ізольованої системи підвищується, якщо система прагне набути стану рівноваги і стає максимальною в цьому стані. Ентропія зростає в усіх реальних термодинамічних процесах.
Фізична суть поняття ентропії: термодинаміка вивчає макроскопічні системи і тому вона не дає жодної інформації про молекулярні механізми, які зумовлюють напрямлену зміну макроскопічних функцій системи. Ентропія є мірою молекулярного хаосу, а її збільшення відображає зростаючу дезорганізацію системи (Людвіг Больцман). Один і той же макрос- тан реалізується величезною кількістю мікростанів, що визначають термодинамічну ймовірність ω системи. На відміну від математичної ймовірності, яка не може бути більшою за одиницю, термодинамічна ймовірність має дуже великі значення і визначається за формулою
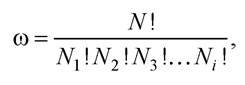
де N = N1 + N2 + N3 + ... - загальна кількість молекул у системі.
Термодинамічна ймовірність - це кількість способів, за якими N молекул можна розмістити в мікрооб’ємах системи.
Ентропія системи відображає показник упорядкованості або хаосу складових системи. Згідно з принципом Больцмана ентропія системи S у рівноважному стані пропорційна термодинамічній імовірності W цього стану:
![]()
де k - константа Больцмана; k = 1,3810 Дж/К.
Термодинамічна ймовірність є кількістю мікростанів системи, за допомогою яких реалізується макростан системи. Чим більша можлива кількість мікростанів (варіантів розміщення частинок), тим більше нев- регульована система, тим більші величини W і S.
Кожна система прагне до переходу з менш імовірного високовпо- рядкованого стану в статистично ймовірніші стани, що характеризуються безладним розміщенням молекул. Кожна система характеризується тенденцією мимовільного переходу до стану максимального молекулярного хаосу.