Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 2. ТЕРМОДИНАМІКА БІОЛОГІЧНИХ ПРОЦЕСІВ ТА СИСТЕМ
2.2.Поняття ентальпії. Закон Гесса
За фіксованого значення тиску р замість внутрішньої енергії U вводять нову функцію стану, яка добре описує поведінку термодинамічної системи. При цьому роботу, що виконується у разі зміни об'єму V (за умов p = const), можна подати таким чином:
![]()
Тоді перший закон термодинаміки набуде вигляду
![]()
Таку нову функцію стану, що визначає тепловий вміст системи, називають ентальпією Н (Дж/моль) і визначають так:
![]()
або у диференціальній формі:![]() якщо р = const.
якщо р = const.
У XIX ст. було доведено експериментально, що перший закон термодинаміки можна застосовувати до процесів, які відбуваються в біологічних системах.
Надходження їжі забезпечує енергію, яка використовується для виконання різних функцій організму або зберігається для подальшого використання. Енергія вивільняється з харчових продуктів у процесі їх біологічного окиснення, яке є багатоступеневим процесом.
Енергія харчових продуктів використовується в клітинах спочатку для синтезу макроергичних сполук, наприклад, аденозинтрифосфорної кислоти (АТФ), яка, у свою чергу, може використовуватися як джерело енергії майже для всіх процесів у клітині незалежно від послідовності та проміжних етапів перетворення енергії. Це показано на принципі Гесса, який є наслідком першого закону термодинаміки.
Закон Гесса: тепловий ефект Q багатоступеневої хімічної реакції не залежить від ходу реакції та її проміжних етапів, а визначається лише різницею ентальпій вихідних речовин та продуктів реакції:
![]()
Приклад 2.2. Визначте кількість теплоти, яка виділяється у процесі окиснення (за умови р = const) 1 моль/л глюкози:
![]()
Розв'язання:
За законом Гесса знаходимо виділену в цій реакції енергію:
![]()
Така ж кількість теплоти виділяється під час окиснення глюкози в організмі тварин [12], коли внаслідок складних хімічних перетворень утворюється багато проміжних продуктів, незважаючи на те, що процес окиснення в них є багатоступеневим процесом.
Теплота Q згоряння, яка виділяється у процесі окиснення речовин, зокрема харчових продуктів, визначається в калориметричних бомбах - приладах, призначених для дослідного спалювання речовин і визначення їх теплотвірної здатності (рис. 2.1). Калориметричну бомбу застосовують для досліджень разом з калориметром. Вона являє собою циліндричну посудину з кислототривкої сталі місткістю 0,3 л з нагвинченою кришкою, на якій розміщено чашки для спалюваного речовини, трубка для підведення кисню, отвори для виходу газу та клеми для підведення електричного струму до тигля, в якому спалюється речовина під час досліду.
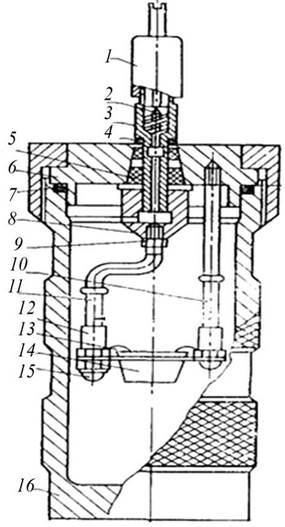
Рис. 2.1. Схема калориметричної бомби:
1 - ковпачок для скидання продуктів згоряння; 2 - золотник; 3 - штуцер; 4 - ізолятор; 5 - втулка;
6 - кришка; 7 - кільце ущільнювача; 8 - гайка спеціальна; 9 - гайка; 10 - стрижень; 11 - тримач тигля;
12 - запалювальний дріт; 13 - втулка; 14 - тигель; 15 - гайка; 16 - стакан
Калориметрична бомба складається з металевого стакана, кришки, гайки та кільця ущільнювача [18]. Із підвищенням тиску в бомбі кільце ущільнювача притискається до стакана і гайки, чим забезпечується герметизація за мінімального тиску 0,3.. .0,4 МПа.
Із зовнішнього боку на кришці бомби розміщено штуцер, призначений для наповнення бомби киснем і відведення продуктів згоряння після вибуху. Він же є електродом, ізольованим від бомби; призначений для підведення електричного струму до запального дроту. Роль іншого електрода виконує корпус бомби.
На внутрішньому боці кришки бомби є два стрижні-утримувачі, на одному з яких кріпиться утримувач тигля і запальний дріт. Другий стрижень призначений для кріплення іншого кінця запального дроту і підведення струму до нього.
Якщо система переходить зі стану 1 у стан 2, змінюючи свій об’єм Δν за умови р = const, то при цьому виконується робота Wp. Загальна робота W = Wp + W0, де W0 - корисна робота, яка виконується для м’язового скорочення або перенесення зарядів через мембрану. Тобто
![]()
Оскільки ΔΗ містить «некорисну» роботу ρΔν, а всі процеси в клітинах відбуваються за постійного тиску, ентальпію найчастіше використовують для опису теплових ефектів у біологічних системах. Якщо людина не виконує зовнішньої роботи, то рівень вивільнення організмом енергії можна визначити за загальною кількістю теплоти, виділеної тілом. Для цього застосовують метод прямої калориметрії, для реалізації якого використовують великий, спеціально обладнаний калориметр. Досліджують організм людини у спеціальній камері, яка добре ізольована від середовища (не відбувається обміну енергією камери з навколишнім середовищем). Кількість теплоти, яка виділилася досліджуваним організмом, можна точно виміряти. Експерименти, виконані цим методом, показали, що кількість енергії, що потрапляє в організм, дорівнює енергії, яка виділяється у процесі калориметрії. Проведення досить прямої калориметрії трудомістке, тому частіше використовують метод непрямої калориметрії, який ґрунтується на обчисленні витрати енергії організмом за кількістю використаного ним кисню.
Будь-який процес окиснення поживної речовини в організмі відбувається зі споживанням цим організмом кисню та вуглекислого газу.
Кількість теплоти, яка виділяється у процесі окиснення поживної речовини, оцінюють дихальним коефіцієнтом δ:
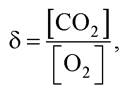
де [CO2] - кількість виділеного вуглекислого газу; [O2] - кількість поглинутого кисню. Кожному δ відповідає свій енергетичний еквівалент Q0 - кількість енергії, яка виділяється у разі поглинання одного літра О2 (табл. 2.1, 2.2).
Таблиця 2.1
Об’єм споживаного кисню О2 та виділеного вуглекислого газу СО2 у разі окиснення 1 г поживної речовини
Речовина |
Споживання О2, л |
Виділення СО2, л |
Дихальний коефіцієнт δ |
Білок |
0,97 |
0,77 |
0,8 |
Жир |
2,0 |
1,4 |
0,7 |
Вуглеводи |
0,83 |
0,83 |
1,0 |
Таблиця 2.2
Дихальні коефіцієнти δ та енергетичні еквіваленти Q0 поживних речовин
Поживні речовини |
Дихальний коефіцієнт δ |
Енергетичний еквівалент Q0, кДж/л |
Вуглеводи |
1,00 |
21,0 |
Білки |
0,80 |
18,8 |
Жири |
0,71 |
19,6 |
Достатня точність вимірювання енергетичного балансу досягається за умов, що організм не виконує роботи і в ньому не нагромаджується біомаса. Відповідно, якщо не виконується робота (W0 = 0), то ΔΗ = 0. У такому разі енергетичні зміни ΔН у біологічній системі можна точно зареєструвати калориметром, якщо вимірювати виділену теплоту Q1і Q2. Якщо значення ΔН > 0, то теплота поглинається, а реакція називається ендотермічною. Якщо ΔН < 0, то система виділяє теплоту, а реакція називається екзотермічною. Більшість метаболічних реакцій є екзотермічними.
Теплота, яка виділяється у разі повного окиснення вуглеводів і жирів до СО2 та Н2О, а також окиснення білків до сечовини, має важливе значення для розрахунку калоричного еквівалента Q0 (кДж/кг) харчових продуктів, який виражає кількість виділеної теплоти, віднесеної до одиниці маси речовини. Зв’язок калоричного коефіцієнта Q0 з дихальним коефіцієнтом δ наведено в табл. 2.3.
Таблиця 2.3
Зв’язок калоричного коефіцієнта Q0 (у разі поглинання 1 л. кисню) з дихальним коефіцієнтом δ
Дихальний коефіцієнт δ |
Калоричний коефіцієнт Q0, кДж/кг |
Дихальний коефіцієнт δ |
Калоричний коефіцієнт Q0, кДж/кг |
Дихальний коефіцієнт δ |
Калоричний коефіцієнт Q0, кДж/кг |
0,70 |
19,619 |
0,81 |
20,151 |
0,92 |
20,716 |
0,71 |
19,636 |
0,82 |
20,201 |
0,93 |
20,767 |
0,72 |
19,686 |
0,83 |
20,256 |
0,94 |
20,821 |
0,73 |
19,737 |
0,84 |
20,306 |
0,95 |
20,871 |
0,74 |
19,791 |
0,85 |
20,360 |
0,96 |
20,921 |
0,75 |
19,841 |
0,86 |
20,411 |
0,97 |
20,976 |
0,76 |
19,896 |
0,87 |
20,461 |
0,98 |
21,026 |
0,77 |
19,946 |
0,88 |
20,515 |
0,99 |
21,076 |
0,78 |
19,996 |
0,89 |
20,566 |
1,00 |
21,131 |
0,79 |
20,051 |
0,90 |
20,616 |
- |
- |
0,80 |
20,101 |
0,91 |
20,666 |
- |
- |
Приклад 2.3. Визначте витрати енергії людини в стані м ’язового спокою, якщо за 10 хв вона видихає 60 л повітря, в якому міститься 15 % кисню і 5 % вуглекислого газу:
Розв’язання:
Визначимо, скільки кисню та вуглекислого газу виділиться за час τ: ![]()
![]() При цьому окиснюється білків:
При цьому окиснюється білків: 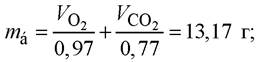 жиру:
жиру: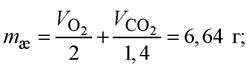 вуглеводів:
вуглеводів: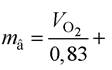
![]() Дихальний коефіцієнт
Дихальний коефіцієнт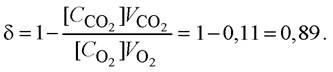
Калоричний еквівалент Q0 =20,566 кДж/хв.
Загальна кількість витрат: Q = Q0τ = 20,566 · 10 = 205,6 кДж;
Q = 186,33 - 78,192 + 88,28 - 41,98 + 229,06 - 76,28 = 307,215 кДж;
![]()
Таким чином, під час дослідження за допомогою калориметра можна визначити середнє значення фізіологічно доступної енергії, яка міститься в одному грамі трьох основних поживних речовин: вуглеводів - 4,1 ккал [1 ккал (кілокалорія) = 4184 Дж]; білків - 4,1 ккал; жирів - 9,3 ккал; спиртів - 7,1 ккал.
Уся енергія, що надходить в організм, перетворюється в теплоту. Під час утворення АТФ лише частина енергії запасається, велика її частина - розсіюється у вигляді тепла. Якщо енергія АТФ використовується функціональними системами організму, то велика частина цієї енергії також переходить у теплову.
Частина енергії, що залишилася в клітинах, витрачається на виконувані ними функції, проте все одно перетворюється в теплоту. Наприклад, енергія, яка використовується м’язовими клітинами, витрачається на подолання сил в’язкого опору м’язів та інших тканин. В’язке переміщення спричиняє тертя, яке зумовлює утворення тепла, наприклад, витрати енергії, що передається серцем кров’яному потоку [48]. Під час руху крові по судинах вся енергія перетворюється у тепло внаслідок тертя між шарами крові та між кров’ю і стінками судин.
Отже, по суті вся енергія, яка була затрачена організмом, зрештою перетворюється в теплоту, за винятком випадку, коли м’язи виконують роботу із зовнішніми тілами.