Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 3. МОЛЕКУЛЯРНА БІОФІЗИКА
3.2.Поняття ферментного каталізу. Уплив температури на швидкість біохімічних реакцій
У живому організмі відбувається величезна кількість оборотних ланцюгових реакцій: гідроліз, розщеплення хімічних зв’язків, утворення нових речовин, ізомеризація, перенесення електронів та протонів тощо. Великих швидкостей біохімічних реакцій неможливо досягти простим збільшенням температури чи тиску. Пришвидшення хімічних перетворень у клітині виникає внаслідок функціонування природних каталізаторів - ферментів, які працюють під дією фізіологічних температур, іонних сил та кислотності.
Деякі особливості характеризують функціонування білків- ферментів. Перша надзвичайно важлива особливість роботи ферментів - це ефективність їхньої каталітичної дії. Каталізовані ферментами реакції перебігають зі швидкостями в 108...1015 раз більшими, ніж відповідні некаталізовані реакції. Друга особливість ферментів визначається їхньою високою специфічністю дії на один тип субстратів.
За термодинамічним підходом основна функція ферментів зводиться до зниження енергетичних бар’єрів хімічних реакцій, які досить великі внаслідок неферментативних перетворень. Наприклад, неферме- нтативне розщеплення перекису водню відбувається з великою енергією активації, Еа = 75 кДж/моль. За участю ферменту каталази енергетичний бар’єр знижується до 8 кДж/моль, унаслідок чого швидкість цієї реакції збільшується в 3·1011 разів.
Комп’ютерне моделювання динаміки структури алкогольдегідрогенази показало [92], що перехід цього ферменту з відкритої конформації у закриту супроводжується обертанням доменів навколо гнучкого «шарніра» на 30°. Якщо б домени мали абсолютно жорстку структуру, то для їх обертання і зближення необхідно було б переборювати великий енергетичний бар’єр - близько 4200 кДж/моль. За фізіологічних температур теплової енергії атомів недостатньо для здолання такого бар’єра. Але повільне обертання доменів супроводжується швидкими флуктуаціями атомної структури, внаслідок чого енергетичний профіль обертання стає більш пологим і теплової енергії вистачає для створення великомасштабного зміщення доменів.
Таким чином, невеликі високочастотні (пікосекундні) флуктуації білкової структури відіграють важливу роль у великомасштабних повільних (понад 10-9 с) зміщеннях доменів. Динаміка білкової структури має вирішальне значення у ферментному каталізі.
Кінетика ферментативних реакцій вивчає механізми та закономірності перебігу хімічних реакцій в часі залежно від концентрації реагуючих речовин та умов їх здійснення (температури, тиску, кислотності тощо). Кількісною характеристикою, за якою описуються кінетичні процеси, є швидкість реакції υ.
Нехай перебігає проста хімічна реакція А + В → Р. Тоді швидкістю реакції υ є зміна в часі концентрації продуктів реакції [Р]:
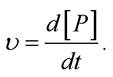
Кінетичне рівняння для цієї реакції має вигляд:
![]()
де k - константа швидкості реакції.
Швидкість хімічної реакції, яка спостерігається на початку реакції, коли не відбулося суттєвих змін концентрації реагуючих речовин, називається початковою швидкістю хімічної реакції υ0. У загальному випадку швидкість реакції залежить від концентрації реагуючих речовин:
![]()
де m - порядок реакції. Залежно від значення m реакції можуть бути: нульового порядку, m = 0 (швидкість не залежить від концентрації реагуючих речовин: υ = kк = const); першого порядку, m = 1: υ = k[Х]; другого порядку, m = 2 і т. д.
Концентрація [А] зменшується за законом
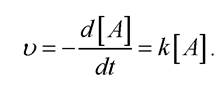
Реакції третього і вищих порядків відбуваються рідко.
Константа к є однією з важливих кінетичних характеристик. Вона відображає частоту активних зіткнень молекул реагуючих речовин. Розмірність к для реакції першого порядку - с-1, для реакції другого порядку - моль-1с-1.
Швидкість хімічних реакцій значно залежить від температури і в загальному вигляді можна подати так: υ = k(T)Cm, де k(Т) - константа швидкості реакції, яка залежить від температури; С - концентрація; m - порядок реакції.
Ареніус запропонував емпіричну залежність швидкості реакції від температури:
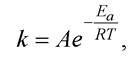
де Еа - енергія активації (енергетичний бар’єр, який переборюють молекули для перебігу реакції); А - передекспоненційний множник.
Передекспоненційний множник А - це частота зіткнень реагуючих молекул. Тоді експоненційний множник (множник Больцмана) визначає частку ефективних зіткнень, які призводять до хімічної реакції (рис. 3.5).
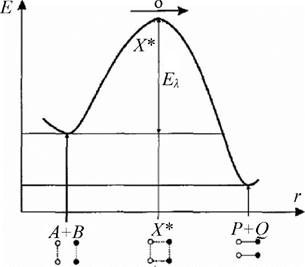
Рис. 3.5. Енергетична крива хімічної реакції: Е - енергетичний рівень; Еа - енергія активації; r - координата реакції; X* - активований комплекс
Теорія абсолютних швидкостей реакцій, на відміну від теорії зіткнень, розглядає хімічну реакцію як складний багатоступеневий процес взаємодії ядер та їхніх електронних оболонок, а не просто зіткнень двох «кульок» [94]. За теорією абсолютних швидкостей реакцій перехід реагуючих молекул у продукти реакції здійснюється через проміжний станзі збільшеною енергією, який називають активованим комплексом. Утворення такого комплексу лімітує швидкість проходження будь-якої хімічної реакції.
За теорією перехідного стану швидкість реакції визначається швидкістю проходження через вершину потенціального бар’єра (рівняння Ейрінга):
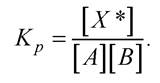
Теплова енергія kТ реагуючих молекул за температури Т = 300 К становить 2,5 кДж/моль, тим часом як енергія активації Еа для багатьох хімічних реакцій - понад 100 кДж/моль.
За теорією Крамерса, яка ґрунтується на моделі руху через бар’єр під дією випадкової сили, стала швидкості реакції буде такою:
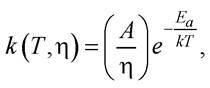
де η - в’язкість мікросередовища.